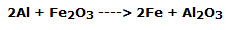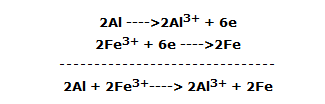Tiempo de lectura estimado: 3 minutos
La reacción aluminotérmica es el corazón del llamado proceso pirometalúrgico o también llamado proceso Goldschmidt para la producción de metales puros, que consiste en la reducción exotérmica de varios óxidos metálicos por el aluminio en polvo. La reacción tiene lugar a alta temperatura, más de 2.800°C.
Se trata de una simple reacción redox que, iniciada por el calor, es, cuando se completa, fuertemente exotérmica. En esta reacción se produce el desplazamiento del hierro de su óxido (reducción), con la formación de gotas de metal fundido, y la oxidación del aluminio a Al2O3, que tiene el aspecto de un sólido blanquecino.
La reacción que se produce es la siguiente:
Con una liberación sustancial de calor
En forma de semirreacciones o iónica la reacción se resume de la siguiente manera
Esta reacción es la base de una importante aplicación práctica, el proceso aluminotérmico, que en su día se utilizó para soldar las vías del tren. La mezcla, llamada termita, era también la base de algunos tipos de artefactos incendiarios.
Materiales
- Ladrillo o material refractario
- Imán
Reactivos
- Óxido de hierro (III)
- Aluminio en polvo fino
- Magnesio en cinta Refractario
Procedimiento – Reacción aluminotérmica
En un crisol de porcelana se mezclan cuidadosamente 1 g de polvo de aluminio y 3 g de óxido de hierro (III). Cuando la mezcla es homogénea, se coloca sobre un ladrillo o un material refractario, formando un pequeño montón en el que se introduce la varilla de magnesio, que actúa como iniciador de la reacción. Se debe tener cuidado de realizar la experiencia alejada de cualquier material que pueda inflamarse fácilmente como madera, cartón o telas
Se prende fuego a la cinta de magnesio y, desde una distancia prudencial, se observa la reacción, que se produce rápidamente con un resplandor y un fuerte desarrollo de calor.
Tras dejar que la reacción se enfríe durante unos segundos, se observan los productos de la reacción; si todo ha transcurrido correctamente, aparecen como masas grisáceas de óxido de aluminio y bolas oscuras de hierro.
Si se dispone de un pequeño imán, es posible reconocer el hierro porque será atraído por él.
Nota operativa: para un buen resultado del experimento es necesario utilizar cantidades estequiométricas de los reactivos, recordando que la masa molecular del aluminio es 26,98 y la masa molecular del Fe2O3 es 159,69. La proporción debe ser siempre de 1:3.
Nota: Debido al riesgo que puede implicar esta reacción, es aconsejable que se haga a modo de demostración para los alumnos que deben estar a una distancia prudencial de la reacción.
Para más información Aluminothermic process
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Como citar este artículo:
APA: (2021-03-31). Reacción aluminotérmica. Recuperado de https://quimicafacil.net/manual-de-laboratorio/q-inorganica/reaccion-aluminotermica/
ACS: . Reacción aluminotérmica. https://quimicafacil.net/manual-de-laboratorio/q-inorganica/reaccion-aluminotermica/. Fecha de consulta 2026-02-17.
IEEE: , "Reacción aluminotérmica," https://quimicafacil.net/manual-de-laboratorio/q-inorganica/reaccion-aluminotermica/, fecha de consulta 2026-02-17.
Vancouver: . Reacción aluminotérmica. [Internet]. 2021-03-31 [citado 2026-02-17]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/q-inorganica/reaccion-aluminotermica/.
MLA: . "Reacción aluminotérmica." https://quimicafacil.net/manual-de-laboratorio/q-inorganica/reaccion-aluminotermica/. 2021-03-31. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net