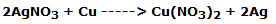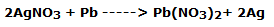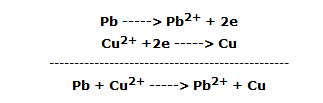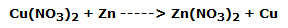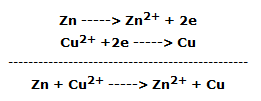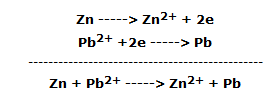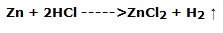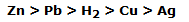Tiempo de lectura estimado: 10 minutos
Una reacción de oxido-reducción (redox) es un tipo de reacción química que implica una transferencia de electrones entre dos especies. Una reacción de oxidación-reducción es cualquier reacción química en la que el número de oxidación de una molécula, átomo o ión cambia al ganar o perder un electrón. Las reacciones redox son comunes y vitales para algunas de las funciones básicas de la vida, como la fotosíntesis, la respiración, la combustión y la corrosión u oxidación.
Materiales
- 16 vasos de precipitados de 100 mL
- Pipeta graduada de 10 mL
- Propipeta o pipeteador
- Probeta de 100 mL
- Pinzas de plástico
Reactivos
- 1 placa metálica de plata
- 4 placas de cobre
- 4 placas de plomo
- 4 placas de zinc
- Nitrato de plata
- Acido clorhídrico 37%
Procedimiento – oxido-reducción
Primera parte: reacciones redox en vasos de precipitados:
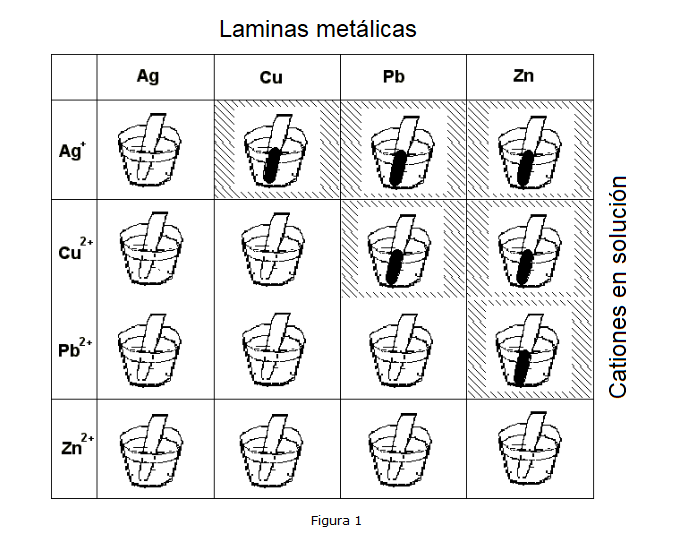
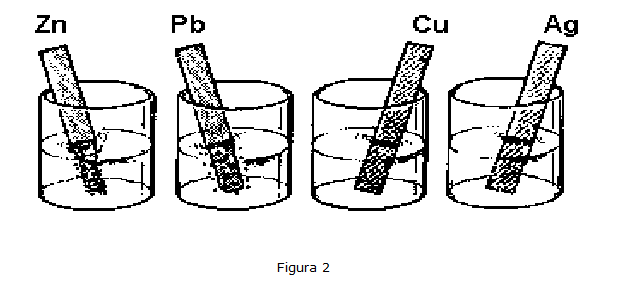
Colocar los vasos de precipitados en cuatro filas. Coloca en los cuatro vasos de la primera fila algunos mL de solución de nitrato de plata 0,1M (o algunos cristales de la sal) y diluye con 40/50 mL de agua destilada.
Preparar, de la manera descrita, soluciones de las otras sales, colocando en la segunda fila el nitrato de cobre II, en la tercera el nitrato de plomo y en la cuarta el nitrato de zinc (ver fig. 1).
Vasos con nitrato de plata:
Se toma una lámina de cada metal y se sumerge en los beckers que contienen solución de AgNO3 y se observa lo que ocurre.
La lamina de plata no da señales de ninguna reacción.
La lámina de cobre, sumergida en el segundo vaso de precipitados, se cubre inmediatamente de un polvo negruzco, mientras se desgasta lentamente. La solución, al mismo tiempo, se vuelve azulada.
Esto indica claramente que el cobre se ha oxidado a Cu2+ mientras que la Ag+ se ha reducido a plata metálica, según la reacción:
En forma iónica:
La lámina de plomo, sumergida en el tercer vaso de precipitados, también se cubre de polvo negruzco, consumiéndose lentamente. El plomo se oxidó a Pb2+ mientras que el Ag+ se redujo a plata según la reacción:
En forma iónica:
En el cuarto vaso sumergimos la lámina de zinc que tiene un comportamiento idéntico. De hecho, el zinc se oxida a Zn2+ mientras que el ion Ag+ se reduce a plata elemental, según la reacción:
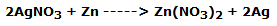
En forma iónica:
Vasos con nitrato de cobre:
Se toma una lámina de cada metal y se sumerge en los beckers de la segunda fila.
Se observa inmediatamente que las láminas de plata y cobre no dan lugar a ninguna reacción de oxidación-reducción.
La lámina de plomo, sumergida en el tercer vaso de precipitados, se cubre de un polvo oscuro, mientras que la solución azul se decolora lentamente: el plomo se ha oxidado a Pb2+ mientras que el Cu2+ se ha reducido a cobre, según la reacción:
En forma iónica:
La lámina de zinc sumergida en el cuarto vaso de precipitados se cubre rápidamente de polvo oscuro, mientras que la solución azul, lentamente, se decolora: el zinc se ha oxidado a Zn2+ mientras que el Cu2+ se ha reducido a cobre metálico, según la reacción:
En forma iónica:
Vasos con nitrato de plomo:
Se toma una lámina de cada metal sumergiéndola en los beckers de la tercera fila:
Se puede observar enseguida que las láminas de plata, cobre y plomo no sufren ningún proceso de oxidación-reducción.
La lámina de zinc, por su parte, se cubre de un polvo negruzco, mientras se consume lentamente: el zinc se oxida a Zn2+ mientras que el Pb2+ se reduce a plomo metálico, según la reacción:
En forma iónica:
Vasos con nitrato de zinc:
Se toma una lámina de cada metal y se sumerge en los beckers de la cuarta fila:
Se puede observar que todas las láminas no muestran ninguna reactividad con la solución, lo que significa que no tiene lugar ningún proceso oxidorreductor.
A partir de los experimentos es posible construir una escala de la tendencia de un elemento a oxidarse:

y, por supuesto, una escala de la tendencia a la contracción de un elemento:
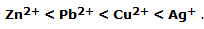
Segunda parte: reactividad del hidrógeno:
Es posible determinar el nivel de reactividad del hidrógeno hacia los metales empleados.
Para ello, tomamos 4 placas de metales y las sumergimos, sucesivamente, en una solución de ácido clorhídrico al 37%, observando lo que ocurre
Las placas de plata y cobre permanecen inalteradas, para significar que no se ha producido ningún proceso de oxidación-reducción.
La placa de plomo, debidamente limpiada con lija, reacciona lentamente consumiéndose y desarrollando en la superficie pequeñas burbujas de gas; el plomo se oxida a Pb2+ mientras que el H+ se reduce a hidrógeno elemental, con formación inmediata de una molécula de H2, con la reacción:
En forma iónica:
La placa de zinc sufre un proceso similar, pero más rápido, con un evidente desarrollo de gas y un rápido consumo del metal; en este caso el zinc se ha oxidado a Zn2+ mientras que el H+ se ha reducido a hidrógeno elemental, con la inmediata formación de una molécula de H2, según la reacción:
En forma iónica:
A partir de los datos experimentales obtenidos, es posible situar al hidrógeno en la escala de tendencia a la oxidación:
y en el de la tendencia a la reducción:
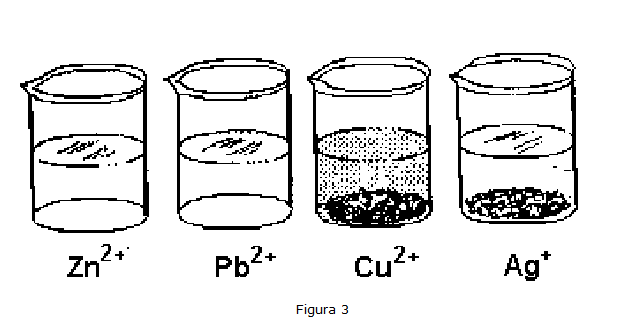
Para confirmarlo, se puede hacer burbujear algo de hidrógeno producido por la reacción del zinc con HCl en una probeta con tubo de desprendimiento lateral, en los vasos de precipitados que contienen las cuatro soluciones de los iones plata, cobre, plomo y zinc (Figura 3); se puede observar que Ag+ y Cu2+ se reducen precipitando bajo forma de polvo metálico de plata y cobre, con oxidación contemporánea de H+ a hidrógeno elemental, según la reacción ya vista, mientras que Zn y Pb no se reducen en absoluto.
Después del laboratorio
Identificar cada semirreacción como semirreacción de oxidación o semirreacción de reducción. Identificar las reacciones envueltas en la segunda parte del experimento.
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información Oxidation-Reduction Reactions
Como citar este artículo:
APA: (2021-03-03). Introduccion a las reacciones de oxido-reduccion. Recuperado de https://quimicafacil.net/manual-de-laboratorio/q-general-basica/introduccion-a-las-reacciones-de-oxido-reduccion/
ACS: . Introduccion a las reacciones de oxido-reduccion. https://quimicafacil.net/manual-de-laboratorio/q-general-basica/introduccion-a-las-reacciones-de-oxido-reduccion/. Fecha de consulta 2026-03-03.
IEEE: , "Introduccion a las reacciones de oxido-reduccion," https://quimicafacil.net/manual-de-laboratorio/q-general-basica/introduccion-a-las-reacciones-de-oxido-reduccion/, fecha de consulta 2026-03-03.
Vancouver: . Introduccion a las reacciones de oxido-reduccion. [Internet]. 2021-03-03 [citado 2026-03-03]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/q-general-basica/introduccion-a-las-reacciones-de-oxido-reduccion/.
MLA: . "Introduccion a las reacciones de oxido-reduccion." https://quimicafacil.net/manual-de-laboratorio/q-general-basica/introduccion-a-las-reacciones-de-oxido-reduccion/. 2021-03-03. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net