Tiempo de lectura estimado: 13 minutos
Introducción al análisis cualitativo de proteínas
Las proteínas son polímeros compuestos de aminoácidos. Se pueden encontrar 20 aminoácidos en la naturaleza y sus diversas combinaciones generan la gran cantidad de proteínas que se pueden encontrar en los distintos tejidos de los seres vivos.
Las propiedades físicas y químicas de las proteínas dependen de diversos factores como los aminoácidos constituyentes, la interacción de los diversos enlaces entre los aminoácidos, interacción entre estructuras proteicas y la relación entre varias proteínas, lo que genera la actividad biológica propia de las proteínas.
Las proteínas tienen diversas funciones como fuente de energía, soporte estructural de tejidos, responsables de procesos biológicos a nivel celular, catalizadores de reacciones entre muchas más.
El análisis de proteínas puede dividirse en análisis cualitativo, que determina la presencia o no de ciertos aminoácidos de interés, análisis cuantitativo, que determina la cantidad de proteína presente en una muestra determinada, y el análisis estructural, que busca determinar los componentes y su organización dentro de una proteína determinada.
Cada uno de los tipos de análisis de proteínas se apoyan en los resultados de los demás para determinar la cantidad, calidad y funcionalidad de una proteína de estudio.
Ensayos cualitativos de proteínas
Los aminoácidos son moléculas orgánicas que contienen en su estructura un grupo amino y un grupo carboxilo. Cuando dos aminoácidos se combinan a través de una reacción de condensación entre el grupo amino de uno y el grupo carboxilo del otros se libera una molécula de agua. El enlace generado se llama enlace peptídico.
Esta molécula conformada por dos aminoácidos recibe el nombre de dipéptido, si se une un tercer aminoácido se generará un tripéptido, y si se unen más, conformaran un polipéptido.
La secuencia de aminoácidos que se encuentran en una proteína recibe el nombre de estructura primaria, y determinara las propiedades sucesivas de la proteína. Las interacciones generadas a través de puentes de hidrogeno entre los átomos que generan el enlace peptídico determinara la estructura secundaria de la proteína. Esta estructura secundaria dependiendo de los aminoácidos presentes en la estructura y su orden puede ser ordenada o no ordenada.
La estructura terciara de una proteína hace referencia al modo en la cadena polipeptídica se pliega en el espacio, esta estructura esta determinada por la estabilización de las interacciones hidrofóbicas de los átomos constituyentes de los aminoácidos. Los aminoácidos apolares se situarán hacia en interior de la proteína mientas los polares se orientarán hacia el exterior en un medio acuoso. La estructura también se estabilizará a través de interacciones de fuerzas de Van der Waals y la formación de puentes disulfuro.
La estructura cuaternaria consiste en la unión de varias cadenas peptídicas asociadas que generan un ente, llamado multímero, con propiedades distintas a las proteínas simples que lo constituyen. Para el caso de la unión de dos proteínas, recibe el nombre de dinero, si ambas proteínas son iguales, se les da en nombre de homodímero, y si son diferentes, heterodímero.
El análisis cualitativo de proteínas implica generalmente la digestión de la muestra para liberar los aminoácidos presentes en la proteína, y el uso de una reacción química que genera un cambio apreciable que indica la presencia o no de uno o más aminoácidos.
Existe la posibilidad de falsos negativos o positivos, como también de interferencia por parte de sustancias presentes en la muestra a analizar, por eso es importante conocer la naturaleza de las muestras y realizar ensayos confirmatorios si es posible.
Los principales ensayos cualitativos en proteínas son los siguientes
Ensayo de Biuret
El ensayo de Biuret detecta la presencia de enlaces peptídicos a través de la reacción de los iones cobre con el nitrógeno de los péptidos formándose un complejo violeta/purpura. Debe su nombre a que también es capaz de detectar la presencia de grupos funcionales Biuret ((H2N-CO-)2NH)
Cadenas pequeñas de polipéptidos da un color rosado, y cadenas mas largas generaran un color mas purpura. La presencia de histidina dará un color rosado,
Ensayo de Ninhidrina
La ninhidrina es un poderoso oxidante que reacciona con el grupo amino de aminoácidos y proteínas a través de una descarboxilación oxidativa en presencia de calor.
La ninhidrina se reduce a hidridantina al reaccionar con el amino acido, que es convertido en aldehído, amoniaco y dióxido de carbono. La hidridantina reacciona con el amoniaco liberado y otra molécula de ninhidrina, generando un complejo purpura/violeta.
Con el aminoácido prolina genera un complejo amarillo característico que sirve de ensayo específico para este aminoácido.
Ensayo xantoprotéico
Algunos compuestos aromáticos reaccionan con ácido nítrico, generándose compuestos nitro y nitroso de color amarillo. Estos compuestos en medio básico generan un color amarillo- naranja intenso.
Los aminoácidos tirosina y triptófano dan resultados positivos a este ensayo, mientras la fenilalanina no reacciona a pesar de tener un anillo bencénico en su estructura.
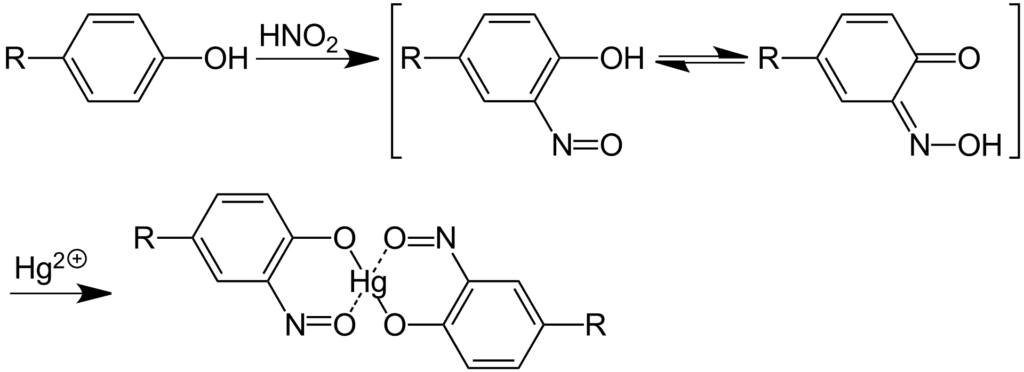
Ensayo de Millon
El ensayo de Millon detecta la presencia del grupo hidroxifenil en las proteínas, aunque es sensible a cualquier compuesto fenólico sin sustituir en las posiciones 3,5. Se considera ensayo positivo para la presencia de tirosina en las proteínas
La reacción se debe a la formación de un compuesto nitro que a su vez genera un complejo de color rojo al reaccionar con un ion mercurio (II). Si se adiciona una gran cantidad de reactivo, puede generarse una coloración amarilla que no es indicativa de reacción positiva.
Ensayo de Hopkins-Cole
El ensayo de Hopkins-Cole, también conocida como la reacción de Adamkiewicz o ensayo del ácido glioxílico, es un ensayo para la detección de triptófano en proteínas.
El ácido sulfúrico concentrado causa la deshidratación del triptófano, que reacciona con el reactivo de Hopkins – Cole, generando un anillo violeta/rojo en la interfase de las dos capas.
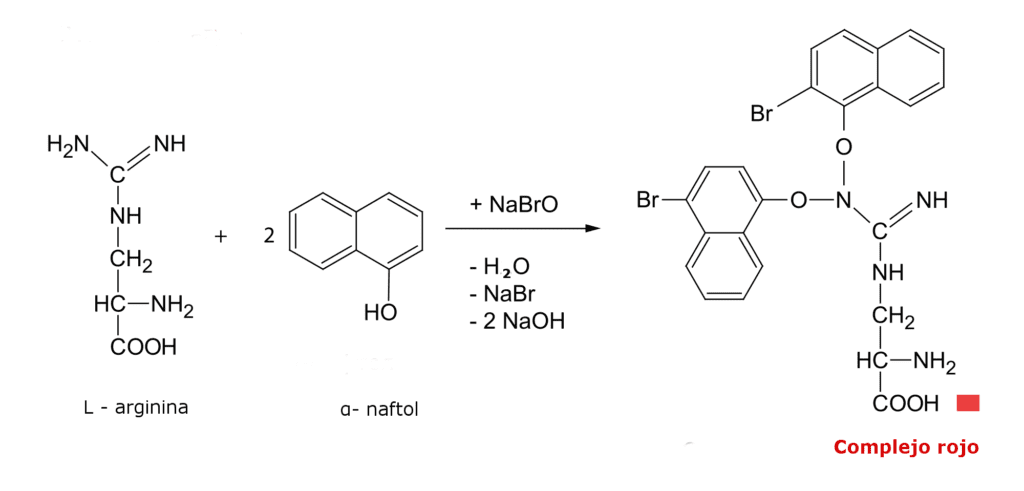
Ensayo de Sakaguchi
El ensayo de Sakaguchi es una prueba específica para la detección del aminoácido arginina en proteínas. También detecta la presencia de derivados de la guanidina.
La arginina reacciona en medio básico con α- naftol en presencia del ion hipobromito generando un complejo de color rojo.
Detección de azufre
Para la detección de aminoácidos que contienen azufre en su estructura como lo son metionina, cisteina, homocisteína y taurina, se libera el azufre del aminoácido en medio básico generando un sulfuro. Posteriormente dicho sulfuro reacciona con acetato de plomo para generar un precipitado de sulfuro de plomo, fácilmente identificable por su color negro.
Materiales
- 20 tubos de ensayo
- Gradilla
- Mechero Bunsen
- Pinza para tubo de ensayo
- Trípode
- Malla de calentamiento
- Mortero
- Erlenmeyer de 50 mL
- Bureta de 25 mL
- Pipeta de 10 mL
- Agitador de vidrio
- Vidrio de reloj
- Espátula pequeña
Reactivos
- Agua destilada
- Solución de hidróxido de sodio 10%
- Solución de hidróxido de sodio 1 N
- Solución de nitrato de plomo (II) 10%
- Acido nítrico concentrado
- Solución de sulfato de cobre (II) 0.5%
- Acido sulfúrico concentrado
- Reactivo de Sakaguchi*
- Ácido Glioxílico
- Reactivo de Millon**
- Solución de acetato de plomo 0.1 M
- Tiras indicadoras de pH en el rango ácido
- Acetato de sodio
- Diferentes fuentes de proteína (Leche de vaca, huevo, gelatina sin sabor, leche de soya, etc.)
- Muestras de aminoácidos puros para realizar tanto pruebas positivas como negativas.
* El reactivo de Sakaguchi consiste en una solución de α- naftol al 1% en etanol con unas gotas de hipobromito de sodio o hipoclorito de sodio.
** El reactivo de Millon puede ser preparado disolviendo 1 g de mercurio metálico en 9 mL de acido nítrico fumante en una campana de gases. Cuando la reacción se complete agregar 9 mL de agua destilada.
Procedimiento – Análisis cualitativo de proteínas
Elegir varias fuentes de proteína entre las disponibles, consulte previamente si algunas de las fuentes de proteína escogidas requieren algún proceso de purificación previo al experimento. Si se dispone de muestras de aminoácidos, manejarlos de manera adecuada para evitar su contaminación.
Ensayo de biuret
Tomar un tubo de ensayo limpio y seco por cada una de las fuentes de proteína a ensayar y aminoácidos puros a ensayar. Marcar cada uno con su nombre respectivo y agregar 0.5 mL o 0.25 g de la sustancia en cuestión (en caso de ser solida agregar 1 mL de agua destilada y agitar).
Adicionar gota a gota solución de sulfato de cobre al 0.5%, agitar y observar la aparición de color violeta en la solución, considerándose ensayo positivo.
Ensayo de ninhidrina
Tomar un tubo de ensayo limpio y seco por cada una de las fuentes de proteína a ensayar y aminoácidos puros a ensayar. Marcar cada uno con su nombre respectivo y agregar 0.5 mL o 0.25 g de la sustancia en cuestión (en caso de ser solida agregar 1 mL de agua destilada y agitar).
Verificar el pH de cada una de las sustancias a ensayar, deben de estar en un rango de 5 – 7, si no, ajustar el pH con algunos cristales de acetato de sodio.
Adicionar 0.5 mL de solución 0.1% de ninhidrina y calentar cuidadosamente hasta ebullición por uno o dos minutos. Dejar enfriar.
El desarrollo de un color azul en la solución se considera resultado positivo.
Ensayo Xantoprotéico
Tomar un tubo de ensayo limpio y seco por cada una de las fuentes de proteína a ensayar y aminoácidos puros a ensayar. Marcar cada uno con su nombre respectivo y agregar 0.5 mL o 0.25 g de la sustancia en cuestión (en caso de ser solida agregar 1 mL de agua destilada y agitar).
Anadir a cada tubo 0.5 mL de acido nítrico concentrado y calentar los tubos a baño de María por 3 minutos. Dejar enfriar.
Agregar cuidadosamente 2 mL de solución de hidróxido de sodio al 10%, se observara la formación de un precipitado blanco que se redisuelve dando un color amarillo intenso. Si no se observa la formación del precipitado agregar más hidróxido de sodio gota a gota hasta generar la reacción deseada. La formación de color se toma como ensayo positivo.
Ensayo de Millon
Tomar un tubo de ensayo limpio y seco por cada una de las fuentes de proteína a ensayar y aminoácidos puros a ensayar. Marcar cada uno con su nombre respectivo y agregar 0.5 mL o 0.25 g de la sustancia en cuestión (en caso de ser solida agregar 1 mL de agua destilada y agitar).
Añadir cuatro gotas de reactivo de Millon a cada tubo y calentar hasta ebullición cuidadosamente a llama. Si no aparece un precipitado color rojo, adicionar tres gotas más y calentar nuevamente. Observar la formación de un precipitado rojo que se considera ensayo positivo.
Ensayo de Hopkins – Cole
Tomar un tubo de ensayo limpio y seco por cada una de las fuentes de proteína a ensayar y aminoácidos puros a ensayar. Marcar cada uno con su nombre respectivo y agregar 0.5 mL o 0.25 g de la sustancia en cuestión (en caso de ser solida agregar 1 mL de agua destilada y agitar).
Agregar 2 mL de ácido glioxílico a cada tubo y mezclar bien. Tomar uno de los tubos de ensayo e inclinar para agregar lentamente por las paredes 1 mL de acido sulfúrico concentrado evitando que se mezclen para formar dos fases. Observar la formación de un anillo violeta en la interfase, siendo esto resultado positivo.
Repetir para cada una de las fuentes de proteína a ensayar.
Ensayo de Sakaguchi
Tomar un tubo de ensayo limpio y seco por cada una de las fuentes de proteína a ensayar y aminoácidos puros a ensayar. Marcar cada uno con su nombre respectivo y agregar 0.5 mL o 0.25 g de la sustancia en cuestión (en caso de ser solida agregar 1 mL de agua destilada y agitar).
A cada uno de los tubos, adicionar 0.5 mL de reactivo de Sakaguchi y agitar. La aparición de un color rojo intenso es resultado positivo.
Detección de azufre
Tomar un tubo de ensayo limpio y seco por cada una de las fuentes de proteína a ensayar y aminoácidos puros a ensayar. Marcar cada uno con su nombre respectivo y agregar 0.5 mL o 0.25 g de la sustancia en cuestión (en caso de ser solida agregar 1 mL de agua destilada y agitar).
Adicionar 2 mL de la solución 1 N de hidróxido de sodio, agitar bien. Posteriormente agregar 1 mL de acetato de plomo y calentar suavemente a la llama. Observar la formación de un precipitado color negro que indica reacción positiva.
Después del experimento
Llenar la siguiente tabla con las observaciones realizadas durante el experimento de análisis cualitativo de proteínas
Identificar que aminoácidos contienen cada fuente de proteína estudiada y confirmar los resultados con los reportado en literatura para cada proteína.
Verificar que interferencias y posibilidades de falsos positivos o negativos pueden suceder con los ensayos y sustancias ensayadas en el laboratorio.
Recomendaciones de seguridad
Realizar las reacciones con la debida precaución, las bocas de los tubos de ensayo deben apuntar hacia un lugar donde no represente peligro.
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Mayor información
Analysis of Proteins
Como citar este artículo:
APA: (2019-03-13). Análisis cualitativo de proteínas. Recuperado de https://quimicafacil.net/manual-de-laboratorio/analisis-cualitativo-de-proteinas/
ACS: . Análisis cualitativo de proteínas. https://quimicafacil.net/manual-de-laboratorio/analisis-cualitativo-de-proteinas/. Fecha de consulta 2026-03-09.
IEEE: , "Análisis cualitativo de proteínas," https://quimicafacil.net/manual-de-laboratorio/analisis-cualitativo-de-proteinas/, fecha de consulta 2026-03-09.
Vancouver: . Análisis cualitativo de proteínas. [Internet]. 2019-03-13 [citado 2026-03-09]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/analisis-cualitativo-de-proteinas/.
MLA: . "Análisis cualitativo de proteínas." https://quimicafacil.net/manual-de-laboratorio/analisis-cualitativo-de-proteinas/. 2019-03-13. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net