Actualizado en julio 25, 2022
Tiempo de lectura estimado: 20 minutos
Theodor Svedberg (30 de agosto de 1884 – 25 de febrero de 1917) fue un químico sueco y ganador del Premio Nobel por sus investigaciones sobre coloides y proteínas utilizando el ultracentrifugador, activo en la Universidad de Uppsala.
- Biografia
- Premio Nobel de química 1926 para Svedberg
- Carrera cientifica de Svedberg
- Svedberg y la radiación
- La centrifuga óptica
- Buscando otras aplicaciones a la ultracentrifugadora
- Aumentando la potencia
- Estudiando otras proteínas con la ultracentrifuga
- Impacto del descubrimiento de Svedberg
- Llevando la ultracentrifugación al limite
- Expandiendo la aplicación de la técnica
- Svedberg y la segunda guerra mundial
- Aplicación de la radiación en el estudio de las proteinas
Biografia
Svedberg era el único hijo de Elias Svedberg y Augusta Alstermark. Su padre, un ingeniero civil, era un hombre muy activo con muchos intereses además de su profesión. Le atraía mucho el estudio de la naturaleza y hacía largas excursiones con su hijo, que compartía su entusiasmo. Trabajó como gerente de una fábrica de hierro en Suecia y Noruega, pero la familia sufría problemas económicos de vez en cuando.

Como estudiante de gimnasia, Theodor Svedberg estaba especialmente interesado en la química, la física y la biología, especialmente en la botánica, y finalmente decidió estudiar química, creyendo que muchos problemas sin resolver en la biología podrían explicarse como fenómenos químicos. En enero de 1904 se matriculó en la Universidad de Uppsala, con la que permaneció asociado durante el resto de su vida. Aprobó los cursos y exámenes necesarios en un tiempo récord y recibió la licenciatura en septiembre de 1905; su primer trabajo científico se publicó en diciembre. Dos años más tarde defendió su tesis, «Studien Zur Lehre von den kolloiden Lösungen«, para el doctorado de filosofía y se convirtió en profesor de química. En 1912 fue nombrado para la primera cátedra sueca de química física.
Cuando, en agosto de 1949, Svedberg alcanzó la edad de jubilación obligatoria para un profesor universitario, una norma especial, única en la administración académica sueca, le permitió convertirse en director del nuevo Instituto Gustaf Werner de Química Nuclear y mantener ese puesto tanto tiempo como quisiera. Renunció en 1967.
Svedberg disfrutó de buena salud durante toda su vida activa, dando largos paseos casi todos los días. Le encantaba hacer excursiones en el campo y recolectar flores silvestres por toda Suecia. Este siguió siendo su hobby de toda la vida, y su herbario finalmente contenía una colección completa de todas las fanerógamas de Suecia. Sus excursiones botánicas se extendían hasta el norte de Groenlandia y Svalbard.
Premio Nobel de química 1926 para Svedberg
Svedberg recibió el Premio Nobel de Química de 1926 por su trabajo en sistemas dispersos y fue galardonado con doctorados honoríficos por las universidades de Groningen, Wisconsin, Uppsala, Harvard, Oxford, Delaware y París. Fue elegido miembro o miembro honorario de más de treinta sociedades científicas, incluyendo la Royal Society, la National Academy of Sciences (Washington), y la academia de ciencias de la U.S.S.R.
Svedberg estaba poco interesado en la política universitaria y rara vez asistía a las reuniones de la facultad. Por otro lado, era muy activo en la promoción de actividades de investigación tanto en la industria como en las universidades. Desempeñó un papel importante en la creación del primer consejo de investigación de Suecia, el Consejo de Investigación para la Tecnología (1942), del que fue miembro hasta 1957. También fue miembro del Consejo de Investigación Atómica de Suecia desde su fundación en 1945 a 1959 y, de 1947 a 1956, miembro de la junta de AB Atomenergi, una compañía parcialmente propiedad del gobierno sueco.
Carrera cientifica de Svedberg
Muy pronto en sus estudios químicos Svedberg encontró libros que estimularon enormemente su pensamiento científico: la edición de 1903 de Theoretische Chemie de Nernst, en la que encontró las secciones sobre coloides, presión osmótica, difusión y pesos moleculares las más interesantes; Zur Erkenntnis der Kolloide de Zsigmondy; y Anorganische Fermente de Gregor Bredig. Svedberg quedó fascinado por el nuevo campo de la química de coloides, que se convirtió en el tema principal de su actovotu científico durante casi dos décadas.
Empezó estudiando la síntesis eléctrica de los soles metálicos en disolventes orgánicos. Bredig había preparado los soles metálicos dejando que una corriente directa se quemara entre los electrodos metálicos bajo la superficie de un líquido. Los soles obtenidos eran, sin embargo, bastante gruesos, polidispersos y contaminados. Svedberg introdujo una bobina de inducción con el hueco de descarga colocado en el líquido. Los resultados fueron sorprendentes. Fue capaz de preparar una serie de nuevos organosoles de más de treinta metales diferentes, y fueron más finamente dispersados y mucho menos contaminados. Además, el método era reproducible, lo que permitía utilizar los soles para estudios fisicoquímicos cuantitativos exactos. Con el ultramicroscopio, Svedberg comenzó a estudiar los movimientos brownianos de las partículas de estos soles y determinó la influencia del disolvente, la viscosidad, la temperatura y otros factores. En 1906 estos estudios proporcionaron una confirmación experimental de las teorías de Einstein y Smoluchowski sobre el movimiento Browniano.

Svedberg y la radiación
Svedberg mantuvo un interés de por vida en los procesos radiactivos. Con D. Strömholm llevó a cabo una investigación pionera sobre la coprecipitación isomórfica de compuestos radiactivos. Diferentes sales fueron cristalizadas en soluciones de varios radioelementos, y se determinó si el radioelemento se cristalizaba o no con las sales. El descubrimiento de que el torio X, por ejemplo, cristalizaba con sales de plomo y bario, pero no con otras, les indicó la existencia de isótopos antes de que Soddy introdujera esa concepción en la química.
En su conferencia Nobel, Soddy se refirió a estos experimentos, cuyos resultados fueron publicados en 1909: «Strömholm y Svedberg fueron probablemente los primeros en intentar encajar una parte de la serie de desintegración en la Tabla Periódica.»
Durante estos años altamente productivos anteriores a 1914 Svedberg publicó muchos trabajos científicos y dos monografías: una (1909) sobre métodos para preparar soluciones coloidales de sustancias inorgánicas, y la otra (1912) que describía su propia contribución experimental a la discusión prevaleciente, pero casi resuelta, sobre si las moléculas existían como partículas o como una concepción matemática.
La centrifuga óptica
De 1913 a 1923 Theodor Svedberg continuó sus estudios de las propiedades fisicoquímicas de la solución coloidal con varios colaboradores. Hacia el final de este período, los problemas fotoquímicos relacionados con la formación y el crecimiento de la imagen latente en la emulsión fotográfica también despertaron su interés.
Durante algún tiempo había sido evidente para Svedberg que, para conocer mejor las propiedades de las soluciones coloidales, necesitaría conocer no sólo los tamaños medios de sus partículas sino también la distribución de frecuencias de los tamaños de las partículas. Para ello, él y H. Rinde desarrollaron un método por el cual la variación de la concentración con la altura en pequeños sistemas de sedimentación podía seguirse por medios ópticos.
Las partículas más pequeñas que este método les permitió determinar en sus soles metálicos eran del orden de 200 m µ de diámetro. Sin embargo, Svedberg estaba interesado en estudiar la formación y el crecimiento de las partículas coloidales, por lo que las partículas muy pequeñas eran especialmente importantes. Para estudiarlas sería necesario aumentar la velocidad de sedimentación, lo que podría hacerse introduciendo métodos centrífugos. El primer intento de hacerlo se hizo en 1923, cuando Svedberg y J. B. Nichols construyeron la primera centrífuga óptica en la que se podía seguir fotográficamente la sedimentación de las partículas durante el recorrido. Sin embargo, no se pudo hacer una determinación adecuada del tamaño de las partículas porque éstas fueron arrastradas hacia abajo tanto por la sedimentación en la parte media de la célula como por la convección y sedimentación combinadas a lo largo de las paredes de la célula en la célula no sectorizada.
Estos experimentos se llevaron a cabo mientras Svedberg era profesor invitado en la Universidad de Wisconsin en Madison. En reconocimiento a su trabajo anterior había sido invitado por el profesor J. H. Mathews a pasar ocho meses en Madison dando conferencias y organizando investigaciones en química de coloides. Aceptó esta invitación con entusiasmo. Le dio la oportunidad de trabajar en un ambiente muy estimulante y demostró ser un punto de inflexión en su carrera científica.
Regresando a Uppsala con muchas ideas nuevas y gran entusiasmo, Svedberg comenzó un programa de investigación más extenso, incluyendo la centrifugación, difusión y electroforesis como métodos para estudiar las propiedades fundamentales de los sistemas coloidales. El problema más urgente era mejorar y reconstruir la centrífuga óptica para hacerla adecuada para la medición cuantitativa de la sedimentación durante el funcionamiento de la centrífuga. Con Rinde introdujo una celda en forma de sector para la solución, uno de los requisitos para obtener una sedimentación sin convección en una celda de centrifugadora giratoria. Derivaron la importante ley de la cuadratura de la contaminación para la sedimentación en estas condiciones. Al principio todavía tenían grandes problemas con las corrientes de convección de calor en las soluciones rotativas; sin embargo, en la primavera de 1924, cuando se permitió que el rotor girara en una atmósfera de hidrógeno, el problema desapareció y se introdujo una nueva herramienta para el estudio de las soluciones coloidales.
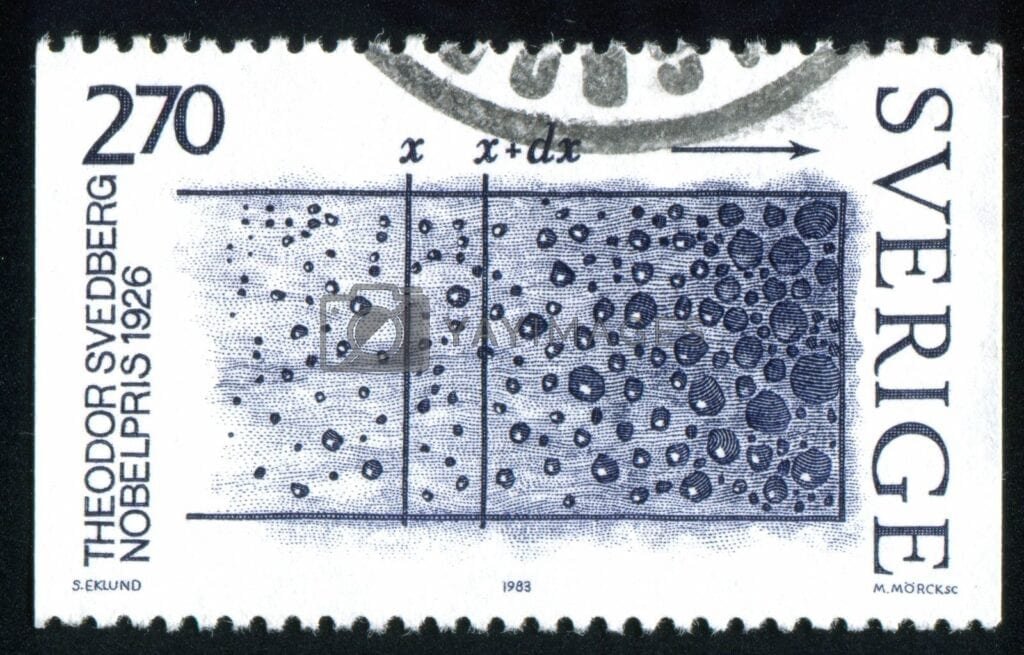
Esta centrífuga permitió seguir ópticamente la sedimentación de partículas demasiado pequeñas para ser vistas incluso en el ultramicroscopio. En analogía con el ultramicroscopio y la ultrafiltración, Svedberg y Rinde propusieron el nombre de «ultracentrifugadora» para el nuevo instrumento. Esta primera ultracentrífuga podía producir un campo centrífugo de hasta 5.000 veces la fuerza de gravedad, y se podía determinar la velocidad de sedimentación de las partículas de oro para partículas tan pequeñas como de unos 5 m µ de diámetro. Los estudios de los soles metálicos por este método fueron continuados por los alumnos de Svedberg, especialmente por Rinde.
Buscando otras aplicaciones a la ultracentrifugadora
El interés de Svedberg se centraba ahora en determinar si su ultracentrifugadora podía ser utilizada en el estudio de otros sistemas coloidales, como las proteínas. Convencido de que eran polidispersas, buscó determinar la distribución de frecuencia de sus tamaños de partículas en soluciones. Los primeros experimentos fueron decepcionantes; no se pudo observar ninguna sedimentación en las soluciones de albúmina de huevo. Experimentos posteriores, realizados en el otoño de 1924, con caseína nativa de la leche mostraron una distribución de frecuencias muy amplia, con partículas gruesas de diámetros del orden de 10 a 70 m µ.
Con Robin Fåhraeus, Svedberg probó la hemoglobina, que efectivamente se sedimentó (octubre de 1924). Después de unos dos días de centrifugación, se estableció el primer equilibrio de sedimentación de una proteína. Se pudo calcular un peso molecular de alrededor de 68.000 a partir de la variación de la concentración de hemoglobina entre el menisco y el fondo de la célula. Combinado con el valor analítico conocido del contenido de hierro de la hemoglobina, mostró la presencia de cuatro átomos de hierro en la molécula de hemoglobina; y dentro del error experimental del método, se encontró que el peso molecular era constante en toda la célula.
Este hallazgo fue una gran sorpresa para Svedberg. ¿Era posible que la proteína tuviera un peso molecular bien definido? ¿Cómo podria probar esta hipótesis? Las mediciones del equilibrio de sedimentación podrían dar alguna indicación de la uniformidad de las partículas, pero este método dificultaba la obtención de información más detallada sobre la homogeneidad de una proteína disuelta. Si se pudiera utilizar el método de la velocidad de sedimentación, un análisis de la forma del límite revelaría la presencia de material no homogéneo. Sin embargo, esto exigiría un campo centrífugo considerablemente mayor; se necesitarían unas 70.000 a 100.000 veces el campo gravitatorio para una sensibilidad razonable. Esto implicaba aumentar la fuerza centrífuga disponible en ese momento entre 15 y 20 veces. Había que construir un tipo completamente nuevo de centrífuga; y había que discutir y resolver una serie de nuevos problemas, relativos a la técnica y la seguridad.
Aumentando la potencia
El 10 de enero de 1926 la nueva ultracentrífuga de turbina de aceite de alta velocidad estaba lista. La prueba fue decepcionante; en lugar de las 40.000-42.000 rpm deseadas, sólo se alcanzaron las 19.000 rpm. Durante los tres meses siguientes se superaron los principales problemas; y aunque quedaban algunos problemas menores, Svedberg pudo empezar a hacer pruebas rutinarias con hemoglobina en la centrifugadora y pudo trabajar en la cuestión general de la uniformidad de las moléculas de proteína.
A partir de estos experimentos de velocidad de sedimentación, concluyó de nuevo que la moglobina en solución daba partículas monodispersas. En los años siguientes se estudiaron en la ultracentrífuga varios tipos diferentes de proteínas, y en muchos casos se encontró que eran paucidispersas (había dos o más clases de tamaño claramente diferentes).
Mediante el fraccionamiento o los cambios de pH, esas soluciones a menudo producían proteínas monodispersas. Además de la caseína, sólo se encontró una proteína polidispersa: la gelatina, que a menudo se utilizaba como «proteína modelo» en esa época. El resultado más sorprendente se obtuvo, según Svedberg, cuando se centrifugó la hemocianina del caracol de tierra Helix pomatia. A partir de su contenido en cobre se había calculado un peso molecular mínimo de 15.000-17.000. Se esperaba, por lo tanto, que durante el proceso se produjera un cambio gradual en la concentración de la célula, que condujera a un equilibrio de sedimentación. Pero, por el contrario, la hemocianina sedimentaba rápidamente con un límite afilado como un cuchillo, lo que indicaba que las partículas de esta proteína eran moléculas gigantes y todas del mismo tamaño. Se encontró que el peso molecular era del orden de cinco millones.
Después de algunos años estudiando varias proteínas, Svedberg concluyó que existían ciertas reglas para los pesos moleculares de las proteínas.
Estudiando otras proteínas con la ultracentrifuga
Posteriormente se estudiaron muchas proteínas nuevas y se descubrió que algunas tenían pesos moleculares inferiores a 35.000, que anteriormente se consideraban la unidad de peso más baja. También se llevó a cabo un amplio estudio de las reacciones de disociación-asociación influidas por el pH, en particular con las hemocianinas, para las que se encontraron pesos moleculares del orden de millones, un descubrimiento sorprendente en aquel momento.
Impacto del descubrimiento de Svedberg
El descubrimiento de Svedberg de que en la mayoría de los casos las proteínas solubles tenían moléculas con un tamaño bien definido y uniforme fue recibido con escepticismo por muchos científicos. Tradicionalmente las proteínas habían sido consideradas como coloides y como sustancias muy complicadas. La hipótesis de Svedberg de la ley múltiple para los pesos moleculares de las proteínas provocó un escepticismo aún mayor, y algunos científicos se preguntaron si Svedberg y sus colaboradores estaban midiendo artefactos. Sin embargo, a principios de los años 30, los estudios de las proteínas por otros métodos comenzaron a corroborar el hallazgo de que estas sustancias tenían moléculas bien definidas y uniformes. Estudios posteriores han confirmado la homogeneidad de las proteínas en mayor medida de lo que Svedberg había previsto.
A finales del decenio de 1930 y principios del de 1940, cuando los estudios de las proteínas distintas de las respiratorias se hicieron más extensos, se formularon severas críticas contra la ley múltiple. Se encontraron muchas proteínas, en Uppsala y en otros lugares, con pesos moleculares considerablemente inferiores a 17.600. Otras proteínas que se estudiaron no encajaban en el sistema de los múltiplos. Con el tiempo se hizo evidente que la ley múltiple no tenía la generalidad que Theodor Svedberg había esperado.
Sin embargo, esta hipótesis fue muy importante para el desarrollo de la química de las proteínas, especialmente en los años 30 y principios de los 40. Inició un mayor interés en las proteínas entre los químicos y proporcionó un impulso para nuevos trabajos. La introducción de la ultracentrifugación a velocidad de sedimentación, y más tarde de la técnica de electroforesis de Tiselius, permitió visualizar de manera mucho más directa hasta qué punto el aislamiento de una proteína individual había tenido éxito.
Llevando la ultracentrifugación al limite
Svedberg se mantuvo intensamente comprometido en el desarrollo de su ultracentrifugación. Para el estudio de la homogeneidad de las proteínas necesitaba una centrífuga que pudiera producir un campo centrífugo mayor que los 100.000 g alcanzados con el primer tipo de ultracentrífuga de alta velocidad (1926). Además, estaba ansioso por ver hasta qué punto se podía desarrollar el método de ultracentrifugación. A partir de 1930, la maquinaria de ultracentrífuga fue completamente reconstruida. Hasta 1939 sus rotores fueron mejorados gradualmente, la mayor parte del desarrollo se concentró en los de tamaño estándar. Se alcanzaron los siguientes valores para el campo centrífugo: 200.000 g (1931), 300.000 g (1932) y 400.000 g (1933). Theodor Svedberg trató entonces de determinar si era posible hacer estudios de sedimentación en campos centrífugos aún más intensos, en un millón de g. Para ello, sería necesario aumentar considerablemente la velocidad del rotor; esto no podía hacerse con los rotores de tamaño estándar, porque se romperían mucho antes de que se alcanzara la velocidad necesaria.
En 1933 y 1934 se hicieron experimentos con tres rotores más pequeños. El primero explotó durante las pruebas. Con el segundo rotor se hicieron algunas pruebas exitosas a 900.000 g antes de que explotara. El tercer rotor se usó para unas pocas carreras a 710.000 g y para muchas carreras a 525.000 g (120.000 rpm). Las células de la solución se deformaron gradualmente en gran medida en los campos de alta centrifugación, y el uso de este rotor fue descontinuado.
Suspendiendo el trabajo posterior en los pequeños rotores, Svedberg se concentró ahora en los de tamaño estándar. Los agujeros de las celdas en los primeros rotores se deformaron durante las pruebas y tuvieron que ser moldeados en forma cilíndrica antes de ser utilizados para las pruebas de rutina. Aun así, una deformación gradual de los agujeros de las celdas ocurrió durante el uso del rotor y aumentó con el tiempo. Se construyeron y probaron varios diseños diferentes de rotores antes de que se lograra finalmente un tipo satisfactorio en enero de 1939.
De los veintidós rotores previamente probados, siete de tamaño estándar y dos pequeños habían explotado. Después de tales explosiones Svedberg estaba a veces a punto de rendirse; no parecía haber esperanza de encontrar un diseño satisfactorio, y se preguntaba si realmente valía la pena dedicar más trabajo a mejorar la ultracentrífuga, o si no sería mejor concentrarse en otros problemas. Sin embargo, su interés por las proteínas y su ansiedad por probar o refutar su hipótesis del sistema múltiple para sus pesos moleculares, le inspiraron a continuar; y después de su jubilación describió este período como el más feliz de su vida científica.
Expandiendo la aplicación de la técnica
A finales de los años 30, Svedberg amplió su interés en las macromoléculas de origen biológico para incluir los polisacáridos. Con N. Gralén descubrió que la savia de los bulbos de varias especies de Liliifloreae contenía sustancias solubles de alto peso molecular. Las diversas especies dieron lugar a diagramas de sedimentación muy diferentes porque contenían proteínas y polisacáridos de diferentes propiedades y en diferentes proporciones. Se podían distinguir dos clases de hidratos de carbono por su comportamiento de sedimentación, y en general se encontró una similitud entre las especies del mismo género en cuanto al contenido de material de alto peso molecular que podía dilucidar problemas en la botánica sistemática.
En la década de 1940 Svedberg y sus colaboradores extendieron sus investigaciones a otros polisacáridos naturales, principalmente para determinar parámetros de tamaño y forma molecular. El cambio gradual de su interés por el estudio de los materiales celulósicos, en particular la celulosa de la madera y los nitratos de celulosa, dio lugar a una estrecha cooperación con los laboratorios de investigación de los mayores fabricantes de celulosa de Suecia.
Svedberg y la segunda guerra mundial
El estallido de la Segunda Guerra Mundial obligó a Svedberg a emprender actividades relacionadas con la guerra. Debido al bloqueo, no se pudo obtener caucho resistente al aceite en el extranjero; y se encargó a Svedberg que desarrollara la producción sueca de caucho sintético (policloropreno). Durante varios años más de la mitad de las instalaciones de investigación de su laboratorio se utilizaron para este desarrollo y para el trabajo de la planta piloto. El proyecto tuvo éxito y dio lugar a una pequeña planta de producción en el norte de Suecia.
El gobierno y otras agencias estatales exigieron mucho tiempo a Svedberg. Institutos e industrias estrechamente relacionadas con los materiales de guerra buscaron su ayuda y su consejo. La planificación necesaria para combinar estas actividades con el trabajo en su instituto le dio menos oportunidades que antes para su propio trabajo experimental y para el contacto con los compañeros de trabajo y los estudiantes.
En relación con el trabajo sobre el caucho sintético, Svedberg realizó estudios fisicoquímicos sobre otros polímeros sintéticos. Siempre estaba buscando nuevas técnicas experimentales para ser usadas en el estudio de estos altos polímeros y de la celulosa. Con I. Jullander desarrolló una balanza osmótica mediante la cual se podían determinar las bajas presiones osmóticas por medio del pesaje. La microscopía electrónica se introdujo en el estudio de la estructura de la celulosa nativa y regenerada. Se utilizaron técnicas de rayos X para las fibras celulósicas y la difracción de electrones para la investigación de micelas y cristalitos.
Aplicación de la radiación en el estudio de las proteinas
El interés de Svedberg en la química de la radiación se reavivó a finales de los años 30 con investigaciones que utilizaban hemocianinas para estudiar el efecto de la luz ultravioleta, las partículas ± y los ultrasonidos en soluciones de estas proteínas. En los años 40, un pequeño generador de neutrones fue construido por uno de sus colaboradores, H. Tyrén, para estudiar la acción de una partícula no cargada sobre las proteínas. Sin embargo, una vez terminado, se utilizó principalmente para la producción de una pequeña cantidad de radiofósforo y algunos otros isótopos radioactivos necesarios en algunos de los institutos médicos de Uppsala. Pronto se planteó la cuestión de cómo aumentar la capacidad de fabricación de isótopos radiactivos. La construcción de un ciclotrón en Uppsala aumentaría inmensamente esa capacidad y abriría nuevos campos de investigación en la química de la radiación allí.

Uno de los viejos amigos de Svedberg en la Facultad de Medicina le propuso que se acercara a Gustaf Werner, un rico industrial de Gotemburgo, sobre la posibilidad de obtener ayuda financiera para construir un gran ciclotrón. La respuesta fue muy positiva, en parte debido al interés de Werner en la posible aplicación médica de dicha investigación. En la primavera de 1946, prometió dar un millón de coronas suecas para la construcción de un ciclotrón. Svedberg inmediatamente hizo planes para el ciclotrón y para la construcción de un instituto de investigación adyacente. Incluso obtuvo fondos adicionales del gobierno, y la construcción del edificio se inició en febrero de 1947. Svedberg había decidido dedicar su tiempo a la creación de este nuevo instituto de investigación y a la planificación del trabajo con el ciclotrón. En diciembre de 1949, unos meses después de su retiro de la cátedra de química física, se inauguró oficialmente el Instituto Gustaf Werner de Química Nuclear, y Svedberg recibió el permiso para continuar sus actividades como director de ese instituto. Sin embargo, pasaron otros dos años antes de que algunos importantes experimentos modelo con el imán y el oscilador fueran satisfactorios y se pudieran hacer las instalaciones finales. A finales del otoño de 1951, se había adquirido el equipo necesario y el sincrociclotrón de 185 MEV estaba en pleno funcionamiento.
Aunque Svedberg había traído algunos colaboradores de su antiguo instituto, tuvo que reunir un nuevo personal y encontrar estudiantes para construir la organización de investigación para su nuevo instituto. Se estudiaron muchos problemas diferentes. Un grupo trabajó principalmente en la aplicación biológica y médica del ciclotrón; otros investigaron el efecto de la radiación en las macromoléculas, problemas en radioquímica y física de la radiación. El instituto pronto se convirtió en el centro de Suecia para la investigación en el área entre la física de alta energía, la química y la biología. El propio interés de Svedberg en la investigación siguió siendo intenso durante toda su vida, y siguió todo el trabajo en curso y asesoró a sus estudiantes y colaboradores. Incluso participó activamente en algunos proyectos de investigación. La última publicación que lleva su nombre (1965) trata de los recientes avances en la radioterapia de protones de alta energía.
Para más información The Svedberg – Facts – NobelPrize.org
Como citar este artículo:
APA: (2021-08-30). Theodor Svedberg. Recuperado de https://quimicafacil.net/infografias/biografias/theodor-svedberg/
ACS: . Theodor Svedberg. https://quimicafacil.net/infografias/biografias/theodor-svedberg/. Fecha de consulta 2024-07-27.
IEEE: , "Theodor Svedberg," https://quimicafacil.net/infografias/biografias/theodor-svedberg/, fecha de consulta 2024-07-27.
Vancouver: . Theodor Svedberg. [Internet]. 2021-08-30 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/infografias/biografias/theodor-svedberg/.
MLA: . "Theodor Svedberg." https://quimicafacil.net/infografias/biografias/theodor-svedberg/. 2021-08-30. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net