Tiempo de lectura estimado: 7 minutos
El progreso en el procesamiento de gases despertó el interés de figuras destacadas como James Clerk Maxwell y Josiah Willard Gibbs, quienes integraron las conclusiones de Andrews en sus trabajos sobre termodinámica. Johannes van der Waals, inspirado por Andrews, desarrolló una ecuación de estado que explicaba el comportamiento de los gases reales, lo que le valió el Premio Nobel de Física en 1910.
La carrera por liquefacer gases previamente no condensables estimuló la innovación, con Louis Cailletet y Raoul Pictet logrando el éxito mediante diferentes métodos de enfriamiento. El uso del efecto Joule-Thomson por parte de Cailletet demostró su aplicación práctica en la liquefacción de gases.
Industria del frio
Estos descubrimientos y esfuerzos interconectados sentaron las bases para avances en criogenia, permitiendo a científicos e ingenieros explorar nuevas fronteras en la física y tecnología de bajas temperaturas. La colaboración y el intercambio de ideas entre científicos de todo el mundo desempeñaron un papel fundamental en la configuración del panorama de la ciencia moderna y sus aplicaciones.
Esta técnica de enfriamiento autointensificante fue clave en el primer método de liquefacción de gas a gran escala desarrollado por William Hampson (1895) y Carl von Linde (1895). En este método, el gas se recirculaba a través de un intercambiador de calor para reducir la temperatura del gas entrante.
En los primeros días de la producción de oxígeno líquido a partir del aire, el uso más extendido del gas fue para la antorcha oxiacetilénica, inventada en Francia en 1904. Esta antorcha revolucionó el corte y la soldadura de metales en la construcción de barcos, rascacielos y otras estructuras de hierro y acero.
Otro método de licuefacción comercial del aire, que utilizaba el enfriamiento adiabático además del efecto Joule-Thomson, fue desarrollado por Georges Claude en 1901 en Francia:
Un subproducto del proceso de licuefacción del aire fue el neón, que generó una nueva y lucrativa industria en forma de iluminación de neón. La primera demostración pública de luces de neón fue en el Salón del Automóvil de París en 1910.
El viernes 10 de julio de 1908, en Leiden, Países Bajos, Kamerlingh Onnes logró liquefacer el único gas restante que anteriormente se pensaba no condensable, el helio, utilizando una técnica secuencial de enfriamiento Joule-Thomson para reducir la temperatura a solo 4 grados por encima del cero absoluto. El evento puso fin a la carrera para liquefacer los llamados gases permanentes, después de la revelación de que todos los gases tienen una temperatura crítica por debajo de la cual deben enfriarse antes de que sea posible la liquefacción.
Este hecho crucial fue establecido por el Dr. Thomas Andrews, profesor de química en el Queen’s College de Belfast, en su estudio innovador sobre la liquefacción del dióxido de carbono, «Sobre la continuidad de los estados gaseoso y líquido de la materia», publicado en las Transacciones Filosóficas de la Royal Society of London en 1869.
Otros aportes de Andrews
El descubrimiento de Andrews de la temperatura crítica (ayudado y alentado por el descubrimiento anterior del enfriamiento isentálpico por parte de Joule y Thomson) abrió el camino a avances criotecnológicos de gran importancia comercial y dio origen a la industria de gases industriales que desempeñó un papel significativo en la configuración del siglo XX.
Este solo hecho fue suficiente para asegurar que el estudio del Dr. Andrews tuviera un lugar en la historia de la ciencia física. Pero había otro aspecto en su artículo, uno teórico, que también tuvo efectos de gran alcance y es el tema del resto de esta publicación.
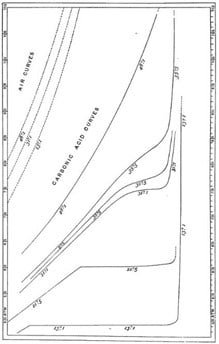
Thomas Andrews fue un científico cuyas habilidades experimentales eran evidentemente comparables a las del ilustre James Joule. Diez años de cuidado y dedicación se dedicaron al estudio de Andrews sobre la licuefacción del dióxido de carbono (llamado ácido carbónico en su época), cuyos resultados esenciales se encuentran en este diagrama tomado de su artículo de 1869.
Es un diagrama de presión-volumen (con la línea de ningún volumen a la derecha) en el que se dibujan las curvas isotermas del dióxido de carbono para temperaturas que van desde 13.1°C hasta 48.1°C y presiones que van desde 50 hasta 100 atmósferas. Se incluyen curvas isotermas del aire en el cuadrante superior izquierdo para ilustrar el grado de desviación de las curvas del dióxido de carbono de la hipérbola rectangular asociada con el comportamiento ideal de los gases.
La curva isotérmica más baja (13.1°C) muestra que, a una presión de alrededor de 47 atmósferas, ocurre la condensación. El gas comprimido se separa en dos porciones coexistentes distintas, vapor y líquido, a lo largo de una línea de presión constante, y una mayor compresión impulsa la conversión a la forma líquida hasta que finalmente todo se convierte en líquido, momento en el cual la compresibilidad se reduce notablemente.
En la siguiente curva isotérmica (21.5°C), donde la condensación ocurre a una presión de aproximadamente 60 atmósferas, el gas y el líquido están aún más cerca en densidad, y el líquido ocupa casi un tercio del volumen del gas. Como lo expresó James Clerk Maxwell en Theory of Heat, escrito en 1871, «el gas extremadamente denso se acerca en sus propiedades al líquido extremadamente ligero».
Estas propiedades coinciden finalmente en el punto isopícno (el punto de inflexión en la isotermia crítica, marcado con X en la figura a continuación) correspondiente a una presión crítica de 72.8 atmósferas y una temperatura crítica de 31°C.
isopícno significa ‘de igual densidad’. El punto isopícno (a veces llamado punto crítico) es donde las densidades de vapor y líquido coinciden; esto ocurre bajo las condiciones de temperatura crítica Tc y presión crítica pc.
Por encima de la temperatura crítica, las isotermas no muestran ninguna discontinuidad; no es posible detectar el punto en el que un líquido se convierte en gas o viceversa. Si el dióxido de carbono líquido, representado por el punto Z en la figura a continuación, se calienta a presión constante hasta que su temperatura alcanza los 48°C, su condición en diferentes temperaturas estará representada por la línea ZY. En Z, la sustancia en cuestión es un líquido; en Y es un gas. El cambio ha tenido lugar suave y continuamente, representando la continuidad de estado.
Fue esta revelación proporcionada por los datos de Andrews lo que hizo que los teóricos comenzaran a pensar en cómo conciliar la idea de continuidad de estado con el cambio discontinuo observado experimentalmente dentro de los límites de la parábola punteada mostrada en la figura.
Coincidencias
La historia de la ciencia está llena de coincidencias: Belfast, en Irlanda del Norte, fue el lugar de nacimiento no solo de Thomas Andrews, sino también de William Thomson (más tarde Lord Kelvin) y su hermano mayor James. William discutía frecuentemente sobre termodinámica con James, quien casualmente era profesor de ingeniería civil en el Queen’s College de Belfast justo en el momento en que Thomas Andrews llevaba a cabo sus famosos experimentos allí.
No sorprendentemente, James Thomson, con sus habilidades prácticas en termodinámica, mostró un interés activo en los resultados notables de Andrews, y en 1871 propuso una solución altamente original al problema de conciliar las isotermas discontinuas por debajo del punto isopicno con las isotermas continuas por encima de él.
La tesis de Thomson era que las partes gaseosa y líquida de una isoterma discontinua (AB y CD en el diagrama anterior) solo eran aparentemente discontinuas y, en realidad, eran partes de una curva suave mostrada en líneas punteadas en el diagrama a continuación. Según Thomson, cada isoterma era una curva continua.
Para más información The Joule-Thomson Effect
Como citar este artículo:
APA: (2024-08-01). 2. La carrera por los gases. Recuperado de https://quimicafacil.net/h_licuefaccion/2-la-carrera-por-los-gases/
ACS: . 2. La carrera por los gases. https://quimicafacil.net/h_licuefaccion/2-la-carrera-por-los-gases/. Fecha de consulta 2025-07-05.
IEEE: , "2. La carrera por los gases," https://quimicafacil.net/h_licuefaccion/2-la-carrera-por-los-gases/, fecha de consulta 2025-07-05.
Vancouver: . 2. La carrera por los gases. [Internet]. 2024-08-01 [citado 2025-07-05]. Disponible en: https://quimicafacil.net/h_licuefaccion/2-la-carrera-por-los-gases/.
MLA: . "2. La carrera por los gases." https://quimicafacil.net/h_licuefaccion/2-la-carrera-por-los-gases/. 2024-08-01. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net