Estimated reading time: 9 minutos
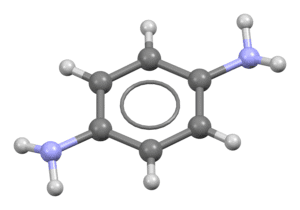
La para-fenilendiamina (abreviada como PPD), cuyo nombre sistemático según la IUPAC es 1,4-diaminobenceno, es un compuesto orgánico aromático derivado del benceno. Se presenta como un sólido cristalino que puede variar en color desde incoloro a amarillo, gris o rosa, pero que se oxida rápidamente al exponerse al aire, adquiriendo tonalidades rojas, marrones y finalmente negras.
Esta propiedad oxidativa es la base de su aplicación más extendida y conocida: como ingrediente principal en la formulación de tintes capilares permanentes para oscurecer el cabello. Además de su uso cosmético, la PPD es un intermediario químico de gran importancia en la industria, especialmente como monómero en la producción de polímeros de alto rendimiento como el Kevlar.
A pesar de su eficacia y popularidad, la PPD es también una molécula controvertida debido a su alto potencial como alérgeno de contacto. Es una de las causas más comunes de dermatitis alérgica relacionada con productos cosméticos, pudiendo provocar desde irritaciones leves hasta reacciones graves que requieren atención médica. Su uso está regulado en muchos países, pero sigue siendo un componente fundamental en más de mil formulaciones de tintes en todo el mundo.
Historia
La para-fenilendiamina fue sintetizada por primera vez en el año 1863 por el químico alemán August Wilhelm von Hofmann. Curiosamente, Hofmann fue el profesor de William Henry Perkin, el joven químico que en 1856 descubrió accidentalmente la malveína, el primer tinte sintético del mundo, inaugurando la era de la química de los colorantes. La síntesis de la PPD por parte de Hofmann se enmarcó en el floreciente campo de la química de las anilinas y los compuestos aromáticos que revolucionó la industria textil y química en la segunda mitad del siglo XIX.
Aunque hoy en día casi toda la PPD se produce sintéticamente a escala industrial, el compuesto también se puede encontrar en la naturaleza como un mineral de color negro en las orillas del río Nilo. Históricamente, en regiones de África, Oriente Medio y la India, la PPD se ha mezclado comúnmente con henna (Lawsonia inermis).
La henna es un colorante natural que tiñe el cabello y la piel de un color rojo oscuro y se utiliza tradicionalmente para decorar las palmas de las manos y los pies, especialmente en celebraciones como las bodas. La adición de PPD a la pasta de henna intensifica el color, produciendo un tono negro profundo y más duradero, dando lugar a lo que se conoce popularmente como «henna negra». Sin embargo, esta práctica es especialmente peligrosa, ya que las concentraciones de PPD en estas mezclas ilegales suelen ser muy superiores a las permitidas en los cosméticos regulados.
Mecanismo de Acción en Tintes Capilares
La PPD es el ingrediente clave en los tintes de oxidación, que son el tipo más común de tinte capilar permanente. A diferencia de los blanqueadores como el peróxido de hidrógeno, que aclaran el cabello al oxidar la melanina, la PPD lo oscurece mediante una serie de reacciones químicas que ocurren directamente dentro de la fibra capilar. El proceso es ingenioso y consta de tres pasos principales:
1. Oxidación de la PPD
El tinte se presenta generalmente como una formulación de dos componentes que se mezclan justo antes de la aplicación: una base alcalina (generalmente amoníaco) que contiene la PPD y otras moléculas precursoras, y un revelador, que es una solución de peróxido de hidrógeno (H₂O₂) .
El amoníaco cumple una doble función: abre las cutículas de la fibra capilar para permitir la entrada de las moléculas del tinte y crea el pH básico necesario para la reacción. En estas condiciones, el peróxido de hidrógeno oxida la para-fenilendiamina, convirtiéndola en una molécula intermedia muy reactiva conocida como quinona-diimina.
$ \text{PPD} + H_2O_2 \xrightarrow{\text{medio básico}} \text{Quinona-diimina} $
2. Reacción de Acoplamiento
La quinona-diimina recién formada es un electrófilo potente que reacciona rápidamente con otras moléculas presentes en la mezcla, conocidas como acopladores (o couplers). Los acopladores son también compuestos aromáticos, como el 1,3-diaminobenceno o el resorcinol. La elección del tipo y la proporción de los acopladores es lo que determina el color final del tinte. Diferentes acopladores producen diferentes colores, desde marrones y rojos hasta negros profundos. Esta reacción es una sustitución electrofílica aromática donde la quinona-diimina se une al acoplador.
3. Oxidación Final y Polimerización
El producto resultante de la reacción de acoplamiento sufre una oxidación final, también mediada por el peróxido de hidrógeno. Este último paso convierte el intermediario en la molécula de colorante final, que es mucho más grande que sus precursores (PPD y acoplador).
Además, estas moléculas de colorante pueden polimerizar parcialmente, formando estructuras aún más grandes. Debido a su gran tamaño, estas moléculas de colorante quedan atrapadas físicamente dentro del córtex del cabello. No pueden ser eliminadas con el lavado, lo que confiere al tinte su carácter permanente. El color permanece hasta que el cabello crece.
Aplicaciones Industriales
Más allá de la industria cosmética, la estructura bifuncional de la PPD, con dos grupos amino en extremos opuestos de un anillo de benceno, la convierte en un monómero ideal para reacciones de polimerización por condensación.
Producción de Polímeros de Alto Rendimiento
La aplicación industrial más significativa de la PPD es como componente clave en la fabricación de aramidas, una clase de fibras sintéticas resistentes al calor y de una fortaleza excepcional. El ejemplo más conocido es el Kevlar®.
El Kevlar se sintetiza mediante la polimerización de PPD y cloruro de tereftaloílo. La estructura rígida y lineal de los polímeros resultantes, junto con la formación de fuertes puentes de hidrógeno entre las cadenas poliméricas, confiere al material su extraordinaria relación resistencia-peso. El Kevlar es cinco veces más resistente que el acero a igual peso y se utiliza en una amplia gama de aplicaciones, desde chalecos antibalas y blindaje de vehículos hasta componentes aeroespaciales y equipamiento deportivo de alto rendimiento. Otro polímero similar, el Twaron®, también utiliza PPD en su fabricación.
Aditivos para Caucho
Debido a su facilidad para oxidarse, algunos derivados de la PPD se utilizan como antioxidantes y antiozonantes en la industria del caucho. Un derivado común es el IPPD (N-isopropil-N’-fenil-1,4-fenilendiamina). El ozono (O₃) atmosférico es uno de los principales agentes de degradación del caucho, causando grietas y fragilidad. El IPPD se añade a la formulación del caucho (por ejemplo, en los neumáticos) porque reacciona con el ozono mucho más rápido que el propio caucho, sacrificándose para proteger la integridad del polímero. Curiosamente, el IPPD también es un alérgeno de contacto y fue el responsable de una afección denominada «Dermatitis de Volkswagen» en 1969, diagnosticada en un paciente que desarrolló dermatitis tras lavar a mano los neumáticos de su coche.
Riesgos para la Salud y Toxicología
La principal preocupación asociada con la PPD es su potencial para causar reacciones de hipersensibilidad de tipo IV, también conocidas como dermatitis alérgica de contacto.
Alergia a la PPD
La PPD es un potente sensibilizante. Esto significa que, tras una primera exposición, el sistema inmunitario de una persona susceptible puede «aprender» a reconocer la molécula como una amenaza. En exposiciones posteriores, el sistema inmunitario desencadena una respuesta inflamatoria en la piel que entra en contacto con la sustancia. La PPD por sí misma es demasiado pequeña para ser reconocida por el sistema inmunitario (es un hapteno), pero una vez que penetra en la piel, se une a proteínas cutáneas, formando un complejo hapteno-proteína que sí es inmunogénico.
Las reacciones pueden variar en severidad:
- Reacciones leves: Enrojecimiento, picazón, sarpullido y descamación en las áreas de contacto, como el cuero cabelludo, la frente, las orejas y el cuello.
- Reacciones graves: Edema pronunciado (hinchazón) de la cara y el cuero cabelludo, formación de ampollas, exudación y dermatitis severa. En casos extremos, la hinchazón puede dificultar la respiración y requerir hospitalización.
En 2006, la PPD fue declarada «Alérgeno de Contacto del Año» por la Sociedad Americana de Dermatitis de Contacto, para concienciar sobre su prevalencia y riesgos. Un caso muy mediático fue el de la actriz Pauley Perrette, conocida por su papel de Abby Sciuto en la serie NCIS, quien en 2014 sufrió una reacción alérgica grave a un tinte capilar, con una hinchazón facial severa que compartió en redes sociales como advertencia.
Sensibilización por Tatuajes de «Henna Negra»
Una de las vías de sensibilización más comunes y peligrosas es a través de los tatuajes temporales de «henna negra». Estos tatuajes, a menudo ofrecidos en lugares turísticos, no contienen solo henna. Se les añade PPD en altas concentraciones (del 10% al 80%, muy por encima del límite legal del 2-6% en tintes capilares) para conseguir un color negro intenso y un secado rápido.
La pasta se deja sobre la piel durante un tiempo prolongado, lo que maximiza la penetración de PPD y el riesgo de sensibilización. Una persona que se sensibiliza a través de un tatuaje de henna negra puede no tener una reacción grave en ese momento, pero si en el futuro utiliza un tinte capilar con PPD, puede sufrir una reacción alérgica explosiva y potencialmente mortal.
Reacciones Cruzadas
Una vez que una persona está sensibilizada a la PPD, su sistema inmunitario puede reaccionar a otras moléculas con una estructura química similar. Esto se conoce como reactividad cruzada. Las personas alérgicas a la PPD pueden desarrollar repentinamente alergias a:
- Tintes Azoicos: Utilizados en ropa, tintas de bolígrafo y cuero.
- Anestésicos locales: Como la benzocaína y la procaína.
- Filtros solares: El ácido para-aminobenzoico (PABA), un antiguo filtro UV.
- Medicamentos: Sulfamidas y otros fármacos derivados de la anilina.
Esto puede complicar enormemente la vida de la persona afectada, que debe evitar una amplia gama de productos cotidianos.
Regulación y Alternativas
Debido a sus riesgos, el uso de PPD está regulado. En la Unión Europea, su concentración máxima en tintes capilares de oxidación está limitada al 2% después de la mezcla. Los productos que la contienen deben llevar advertencias claras en la etiqueta, como «Puede provocar una reacción alérgica» y «No utilizar para teñir cejas o pestañas». Se recomienda siempre realizar una prueba de parche 48 horas antes de cada aplicación para detectar una posible sensibilización.
La investigación se centra en desarrollar alternativas más seguras. Algunas de las que ya se utilizan incluyen:
- 2,5-diaminotolueno (PDT): Menos potente como sensibilizante que la PPD, aunque todavía puede causar alergias.
- 2,5-diamino(hidroxietil)benceno: Considerado menos tóxico.
- Derivados de la PPD: Investigadores están modificando la molécula de PPD, por ejemplo, añadiendo grupos hidrofílicos (como cadenas de éter) para aumentar su solubilidad en agua. La teoría es que una molécula más hidrosoluble tendría más dificultades para penetrar la barrera lipídica de la piel, reduciendo su interacción con las proteínas cutáneas y, por tanto, su potencial alergénico. Los resultados preliminares son prometedores, mostrando una respuesta inflamatoria reducida en pruebas de laboratorio.
Como citar este artículo:
APA: (2026-02-17). Parafenilendiamina. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/parafenilendiamina/
ACS: . Parafenilendiamina. https://quimicafacil.net/compuesto-de-la-semana/parafenilendiamina/. Fecha de consulta 2026-02-17.
IEEE: , "Parafenilendiamina," https://quimicafacil.net/compuesto-de-la-semana/parafenilendiamina/, fecha de consulta 2026-02-17.
Vancouver: . Parafenilendiamina. [Internet]. 2026-02-17 [citado 2026-02-17]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/parafenilendiamina/.
MLA: . "Parafenilendiamina." https://quimicafacil.net/compuesto-de-la-semana/parafenilendiamina/. 2026-02-17. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net