Actualizado en junio 26, 2023
Tiempo de lectura estimado: 8 minutos
El 2,2,4-Trimetilpentano, también conocido como isooctano o iso-octano, es un compuesto orgánico con la fórmula (CH3)3CCH2CH(CH3)2. Es uno de los varios isómeros del octano (C8H18). Este isómero en particular es el estándar de 100 puntos en la escala de octanaje (el punto cero es n-heptano). Es un componente importante de la gasolina, frecuentemente usado en proporciones relativamente grandes para aumentar la resistencia al golpe del combustible.
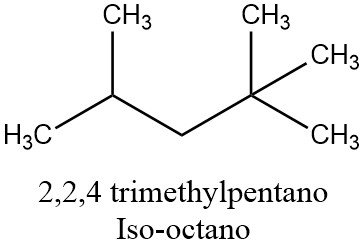
Estrictamente hablando, si se sigue el significado estándar de ‘iso’, el nombre isooctano debería cambiarse al del isómero 2-metilheptano. Sin embargo, el 2,2,4-trimetilpentano es, con mucho, el isómero más importante del octanaje y por eso, históricamente, se le ha asignado este nombre.
Índice de octano
El octano es uno de los pocos nombres químicos que forma parte de la vida cotidiana y es reconocido por el público. Cuando te detienes en una estación de servicio o gasolinera para llenar el depósito, normalmente ves el octanaje del combustible que aparece en la bomba, 95 o 97, pero ¿qué significa?

Para entenderlo, hay que retroceder casi un siglo. En los primeros días del automóvil, el golpeteo o el pre-encendido era un verdadero problema. Un motor de gasolina, la mezcla gaseosa de aire y combustible de hidrocarburo se inyecta en el cilindro cuando el pistón está en su recorrido descendente, y luego se comprime cuando el pistón se mueve hacia arriba.
En un punto determinado, una bujía dispara una chispa que enciende la mezcla, y los gases calientes resultantes crean la potencia que obliga al pistón a bajar, impulsando el motor y accionando las ruedas. Los motores más sofisticados tenían relaciones de compresión más altas – la mezcla de aire y combustible se comprimía más antes de encenderse, pero esto también hacía más probable que la mezcla se preencendiera, causando que el motor fallara – golpeando – y perdiera potencia.
Buscando reducir el golpeteo
A mediados de la década de 1920, un químico americano llamado Russell Marker, que trabajaba para la Ethyl Corporation, hizo un estudio sistemático de las características de golpeteo de los diferentes hidrocarburos. Empezó mirando el heptano, un hidrocarburo de «cadena lineal». Los químicos tienden a referirse a estas cadenas como «cadenas rectas», pero en realidad son cualquier cosa menos rectas. En el mejor de los casos tienen una cadena en zig-zag de átomos de carbono, con hidrógenos adheridos, aunque a temperatura ambiente las cadenas se flexionan. De todos modos, el heptano causó un golpeteo realmente malo.

Luego eligió lo que llamamos 2,2,4-trimetilpentano, que en ese momento se conocía como isooctano. Este tenía una cadena ramificada de ocho átomos de carbono, pero lo mejor era que no causaba ningún golpeteo. Sin embargo, cuando probó el octano ordinario, que tenía una cadena recta de ocho carbones, eso también fue malo. Así que los científicos hicieron mezclas con cantidades variables de heptano e iso-octano para estudiar sus características de golpeteo. Un combustible descrito como 95 octanos tiene las mismas características de golpeteo que una mezcla que contiene 95% de isooctano y 5% de heptano. Cuanto mayor sea el índice de octano, más se puede comprimir la mezcla de gas/aire antes de la ignición, y más potencia se obtendrá.
Ahora, por supuesto, no puedes obtener moléculas como el octano y el isooctano sólo con golpearlas desde un árbol como puedes obtener látex para hacer caucho. Tienen que ser obtenidas del petróleo crudo.
Obtener el iso-octano
Hace muchos millones de años, la materia orgánica como el plancton se acumuló en el fondo del mar. Con el paso del tiempo, se enterró más y más profundamente, de modo que eventualmente, a medida que las capas se endurecían y se convertían en esquisto o lodo, las moléculas orgánicas estaban sujetas a una presión y temperatura cada vez mayor. Esto causó que las moléculas grandes se dividieran en una variedad de moléculas más pequeñas con cadenas más cortas. Esta mezcla es petróleo crudo, e impregna la roca, «roca fuente» como la llaman los geólogos.
Al encontrar petróleo, una compañía petrolera tiene que refinar su producto crudo, ya que no sirve como combustible. En parte esto significa destilarlo, y recoger las fracciones con diferentes puntos de ebullición. Otra forma de obtener combustibles valiosos es mediante procesos conocidos como reformado y craqueo, este último haciendo el mismo tipo de cosas que ocurren cuando se forma el petróleo crudo en primer lugar, utilizando calor (y catalizadores) para romper las moléculas de cadena larga con altos puntos de ebullición en moléculas más pequeñas y volátiles, que son combustibles más valiosos. También producen alcanos de cadena ramificada, como el isooctano, mediante reacciones de isomerización.
Aditivos, otra manera de aumentar el índice de octano
Hay otras formas de aumentar el índice de octano. Una es añadir el tetraetilo de plomo. Esto se hizo a partir de los años 20, pero tenía la desventaja de ser tóxico – muchos trabajadores de las empresas que fabricaban TEL murieron en la primera década de producción. Y después de que el combustible se quemaba, el plomo tóxico entraba en el medio ambiente. Otra forma es añadiendo benceno y otros hidrocarburos aromáticos, pero el benceno en particular es tóxico, creando otro problema.
El combustible de alto octanaje es de importancia históricamente. Puede que no suponga una gran diferencia para un coche, pero hace setenta y cinco años, supuso una diferencia significativa para los motores de los aviones. El Supermarine Spitfire tuvo sus orígenes en los hidroaviones que ganaron el trofeo Schneider de alta velocidad para Gran Bretaña tres veces en 1927-1931, cuando el comodoro Rod Banks y otros desarrollaron combustibles de alto octanaje para esto. El combustible de 100 octanos de las refinerías de Aruba, frente a la costa venezolana, se utilizó en escuadrillas con los Hurricanes y los Spitfires de la RAF en 1939-40, a tiempo para la Batalla de Gran Bretaña. La Luftwaffe estaba introduciendo combustible de 100 octanos al mismo tiempo, y sin él la RAF podría haber estado en una verdadera desventaja.


Producción actual del iso-octano
El isooctano se produce a escala masiva en la industria petrolera por alquilación de isobuteno con isobutano. El proceso se lleva a cabo en unidades de alquilación en presencia de catalizadores ácidos.

También se puede producir a partir del isobutileno por dimerización utilizando un catalizador de Amberlyst para producir una mezcla de isooctenos. La hidrogenación de esta mezcla produce 2,2,4-trimetilpentano.
Russell Marker
Y Russell Marker, ¿se pregunta? Bueno, se convirtió en uno de los pocos profesores universitarios que no tenía un doctorado. Poco más de 10 años después de su trabajo sobre los índices de octano, encontró una forma de degradar la diosgenina, que se encuentra en los ñames mexicanos, en progesterona, lo que se conoció como la degradación Marker, un ejemplo práctico de la semisíntesis. Esto condujo finalmente al desarrollo de los anticonceptivos orales. La gente ha ganado premios Nobel por trabajos menos valiosos.
Uso del octanaje en la cultura popular
El octanaje se hizo muy conocido en la cultura popular estadounidense a mediados y finales del decenio de 1960, cuando las compañías de gasolina se jactaron de los niveles de «alto octanaje» en sus anuncios de gasolina.
El adjetivo compuesto «alto octanaje», que significa potente o dinámico, se registra en sentido figurado a partir de 1944. A mediados del decenio de 1990, la frase se utilizaba comúnmente como intensificador y ha encontrado un lugar en la lengua vernácula del inglés moderno.
Para más información Iso-octane – PubChem – NIH
Como citar este artículo:
APA: (2021-01-19). Iso-octano. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/iso-octano/
ACS: . Iso-octano. https://quimicafacil.net/compuesto-de-la-semana/iso-octano/. Fecha de consulta 2024-07-27.
IEEE: , "Iso-octano," https://quimicafacil.net/compuesto-de-la-semana/iso-octano/, fecha de consulta 2024-07-27.
Vancouver: . Iso-octano. [Internet]. 2021-01-19 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/iso-octano/.
MLA: . "Iso-octano." https://quimicafacil.net/compuesto-de-la-semana/iso-octano/. 2021-01-19. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net