Estimated reading time: 5 minutos
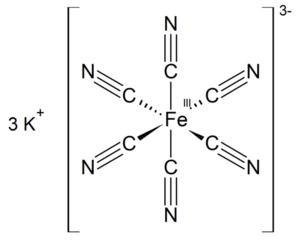
El ferricianuro de potasio es el compuesto químico con la fórmula \( K_3[Fe(CN)_6] \). Esta sal de color rojo brillante contiene el ion octaédrico \([Fe(CN)_6]^{3-}\). Es soluble en agua y su solución presenta cierta fluorescencia verde-amarilla. Fue descubierto en 1822 por Leopold Gmelin.
Preparación del ferricianuro de potasio
El ferricianuro de potasio se fabrica haciendo pasar cloro a través de una solución de cianuro de potasio ferroso:
Estructura
Al igual que otros cianuros metálicos, el ferricianuro de potasio sólido tiene una estructura polimérica complicada. El polímero consiste en centros octaédricos \([Fe(CN)_6]^{3-}\) entrelazados con iones \(K^+\) que están unidos a los ligandos \(CN\). Los enlaces \(K^+—NCFe\) se rompen cuando el sólido se disuelve en agua.
Aplicaciones
El compuesto también se utiliza para endurecer hierro y acero, en electrochapado, en la tintura de lana, como reactivo de laboratorio y como agente oxidante suave en química orgánica.
Fotografía
El ferricianuro de potasio tiene un uso generalizado en el dibujo de planos y en fotografía (proceso de cianotipo). Varios procesos de tonificación de impresiones fotográficas involucran el uso de ferricianuro de potasio. A menudo se utiliza como un blanqueador suave en una concentración de 10 g/L para reducir la densidad de película o impresión.
Blanqueo
Se utilizó como agente oxidante para eliminar plata de negativos y positivos en color durante el procesamiento, un proceso denominado blanqueo.
Debido a que los blanqueadores a base de ferricianuro de potasio son perjudiciales para el medio ambiente, de corta duración y capaces de liberar gas cianhídrico si se mezclan con altas concentraciones y volúmenes de ácido, se han utilizado blanqueadores con EDTA férrico en el procesamiento de color desde la introducción del proceso Kodak C-41 en 1972.
En litografía a color, el ferricianuro de potasio se utiliza para reducir el tamaño de los puntos de color sin reducir su número, en un tipo de corrección de color manual llamada grabado de puntos.
Reductor de Farmer
El ferricianuro de potasio también se utiliza en fotografía en blanco y negro con tiosulfato de sodio (hipo) para reducir la densidad de un negativo o impresión en gelatina de plata, donde la mezcla se conoce como reductor de Farmer; esto puede ayudar a compensar problemas de sobreexposición del negativo o a iluminar los reflejos en la impresión.
Reactivo en síntesis orgánica
El ferricianuro de potasio se utiliza como un oxidante en química orgánica. Es un oxidante para la regeneración de catalizadores en dihidroxilaciones de Sharpless.
Sensores e indicadores
El ferricianuro de potasio es uno de los dos compuestos presentes en la solución indicadora de ferroxilo (junto con fenolftaleína) que se torna azul (azul de Prusia) en presencia de iones \(Fe^{2+}\), y que por lo tanto puede utilizarse para detectar la oxidación metálica que llevará a la corrosión. Es posible calcular el número de moles de iones \(Fe^{2+}\) utilizando un colorímetro, debido al intenso color del azul de Prusia.
En experimentos fisiológicos, el ferricianuro de potasio proporciona un medio para aumentar el potencial redox de una solución (\(E°’ \sim 436 \, \text{mV}\) a pH 7). Como tal, puede oxidar el citocromo c reducido (\(E°’ \sim 247 \, \text{mV}\) a pH 7) en mitocondrias aisladas. El dithionito de sodio se utiliza generalmente como un agente reductor en tales experimentos (\(E°’ \sim -420 \, \text{mV}\) a pH 7).
El ferricianuro de potasio se utiliza para determinar el potencial de reducción férrica de una muestra (extracto, compuesto químico, etc.). Esta medición se utiliza para determinar la propiedad antioxidante de una muestra.
El ferricianuro de potasio es un componente de biosensores amperométricos como agente de transferencia de electrones, reemplazando al agente de transferencia de electrones natural de la enzima, como el oxígeno en la enzima glucosa oxidasa. Es un ingrediente en los medidores de glucosa en sangre disponibles comercialmente para uso por diabéticos.
Otros
El ferricianuro de potasio se combina con hidróxido de potasio (o hidróxido de sodio como sustituto) y agua para formular el grabador de Murakami. Este grabador es utilizado por metalógrafos para proporcionar contraste entre las fases de aglutinante y carburo en carburos cementados.
Azul de Prusia
El azul de Prusia, el pigmento azul profundo en la impresión en azul se genera por la reacción de \( K_3[Fe(CN)_6] \) con iones ferrosos (\(Fe^{2+}\)) así como \( K_4[Fe(CN)_6] \) con sales férricas.
En histología, el ferricianuro de potasio se utiliza para detectar hierro ferroso en tejido biológico. Reacciona con hierro ferroso en solución ácida para producir el pigmento insoluble azul, comúnmente conocido como azul de Turnbull o azul de Prusia. Para detectar hierro férrico (\(Fe^{3+}\)), se utiliza cianuro de potasio ferroso en el método de tinción de azul de Prusia de Perls.
Seguridad
El ferricianuro de potasio tiene baja toxicidad, siendo su principal peligro que es un irritante leve para los ojos y la piel. Sin embargo, bajo condiciones muy ácidas, se libera gas cianhídrico altamente tóxico, según la ecuación:
Para más información Potassium ferricyanide
Como citar este artículo:
APA: (2025-11-18). Ferricianuro de potasio. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/ferricianuro-de-potasio/
ACS: . Ferricianuro de potasio. https://quimicafacil.net/compuesto-de-la-semana/ferricianuro-de-potasio/. Fecha de consulta 2026-02-17.
IEEE: , "Ferricianuro de potasio," https://quimicafacil.net/compuesto-de-la-semana/ferricianuro-de-potasio/, fecha de consulta 2026-02-17.
Vancouver: . Ferricianuro de potasio. [Internet]. 2025-11-18 [citado 2026-02-17]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/ferricianuro-de-potasio/.
MLA: . "Ferricianuro de potasio." https://quimicafacil.net/compuesto-de-la-semana/ferricianuro-de-potasio/. 2025-11-18. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net