Tiempo de lectura estimado: 6 minutos
El difluoruro de oxígeno es un compuesto de flúor y oxígeno con la fórmula molecular O2F2. Puede existir como un sólido de color naranja que se funde en un líquido rojo a -163 °C (110 K). Es un oxidante extremadamente fuerte y se descompone en oxígeno y flúor incluso a -160 °C (113 K) a un ritmo del 4% por día: su vida a temperatura ambiente es, por tanto, extremadamente corta.
El difluoruro de dióxido de carbono reacciona vigorosamente con casi todos los productos químicos con los que se encuentra -incluso con el hielo ordinario- lo que le ha valido el apodo onomatopéyico de «FOOF» (un juego de su estructura química y sus tendencias explosivas).
Síntesis del difluoruro de oxígeno
El difluoruro de oxígeno puede obtenerse sometiendo una mezcla 1:1 de flúor gaseoso y oxígeno a baja presión (7-17 mmHg (0,9-2,3 kPa) es lo óptimo) a una descarga eléctrica de 25-30 mA a 2,1-2,4 kV. Un método similar se utilizó para la primera síntesis de Otto Ruff en 1933.
Otra síntesis implica la mezcla de O2 y F2 en un recipiente de acero inoxidable enfriado a -196 °C (77,1 K), seguido de la exposición de los elementos a 3 MeV de radiación de frenado durante varias horas. Un tercer método requiere calentar una mezcla de flúor y oxígeno hasta 700 °C (1.292 °F), y luego enfriarla rápidamente usando oxígeno líquido. Todos estos métodos implican la síntesis según la ecuación
También surge de la descomposición térmica del difluoruro de ozono:
O
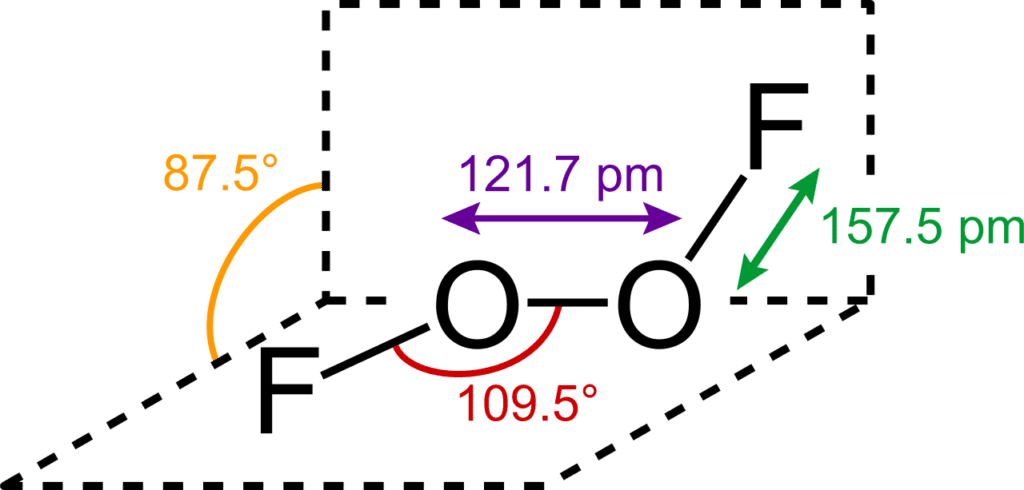
Estructura
En el O2F2, al oxígeno se le asigna el inusual estado de oxidación de +1. En la mayoría de sus otros compuestos, el oxígeno tiene un estado de oxidación de -2.
La estructura del difluoruro de oxígeno se parece a la del peróxido de hidrógeno, H2O2, en su gran ángulo diedro, que se aproxima a los 90° y a la simetría C2. Esta geometría se ajusta a las predicciones de la teoría VSEPR.
La unión dentro del difluoruro de oxígeno ha sido objeto de una considerable especulación, en particular debido a la muy corta distancia O-O y las largas distancias O-F. La longitud del enlace O-O está dentro de las 2 pm de la distancia de 120,7 pm para el doble enlace O=O en la molécula de oxígeno, O2.
Se han propuesto varios sistemas de enlace para explicar esto, incluyendo un triple enlace O-O con enlaces simples O-F desestabilizados y alargados por la repulsión entre los pares solitarios en los átomos de flúor y los π orbitales del enlace O-O. La repulsión que involucra a los pares solitarios de flúor también es responsable de la larga y débil unión covalente en la molécula de flúor.
La química computacional indica que el difluoruro de oxígeno tiene una barrera extremadamente alta a la rotación de 81,17 kJ/mol alrededor del enlace O-O (en el peróxido de hidrógeno la barrera es de 29,45 kJ/mol), esto es cercano a la energía de disociación del enlace O-F de 81,59 kJ/mol.
El desplazamiento químico de RMN 19F del difluoruro de oxígeno es de 865 ppm, que es, con mucho, el desplazamiento químico más alto registrado para un núcleo de flúor, lo que subraya las extraordinarias propiedades electrónicas de este compuesto. A pesar de su inestabilidad, los datos termoquímicos del O2F2 se han compilado.
Reactividad
El compuesto se descompone fácilmente en oxígeno y flúor. Incluso a una temperatura de -160 °C (113 K), el 4% se descompone cada día por este proceso:
La otra propiedad principal de este compuesto inestable es su poder oxidante, aunque la mayoría de las reacciones experimentales se han llevado a cabo cerca de -100 °C (173 K). Varios experimentos con el compuesto dieron lugar a una serie de incendios y explosiones. Algunos de los compuestos que produjeron reacciones violentas con el O2F2 incluyen el alcohol etílico, el metano, el amoníaco e incluso el hielo.
Con el BF3 y el PF5, da las correspondientes sales de dioxigenilo:
Usos del difluoruro de oxigeno
El compuesto no tiene actualmente aplicaciones prácticas, pero ha sido de interés teórico. Un laboratorio lo utilizó para sintetizar hexafluoruro de plutonio a temperaturas sin precedentes, lo que fue significativo porque los métodos anteriores de preparación necesitaban temperaturas tan altas que el hexafluoruro de plutonio creado se descompondría rápidamente.
Para más información Things I Won’t Work With: Dioxygen Difluoride
Como citar este artículo:
APA: (2022-01-18). Difluoruro de oxígeno. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/difluoruro-de-oxigeno/
ACS: . Difluoruro de oxígeno. https://quimicafacil.net/compuesto-de-la-semana/difluoruro-de-oxigeno/. Fecha de consulta 2026-02-27.
IEEE: , "Difluoruro de oxígeno," https://quimicafacil.net/compuesto-de-la-semana/difluoruro-de-oxigeno/, fecha de consulta 2026-02-27.
Vancouver: . Difluoruro de oxígeno. [Internet]. 2022-01-18 [citado 2026-02-27]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/difluoruro-de-oxigeno/.
MLA: . "Difluoruro de oxígeno." https://quimicafacil.net/compuesto-de-la-semana/difluoruro-de-oxigeno/. 2022-01-18. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net