Estimated reading time: 9 minutos
Diborano(6), comúnmente conocido como diborano, es el compuesto químico con la fórmula \( \text{B}_2 \text{H}_6 \). Es un gas incoloro, altamente tóxico y pirofórico, con un olor dulzón y repulsivo.
Dada su fórmula sencilla, el diborano es un compuesto fundamental del boro, y ha atraído una considerable atención debido a su estructura electrónica. Varios de sus derivados son reactivos útiles.
Características
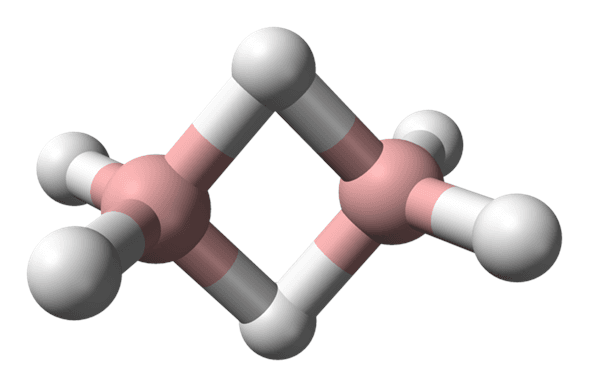
El diborano es una molécula con la fórmula \( \text{B}_2 \text{H}_6 \). A primera vista, parece análogo al etano (\( \text{C}_2 \text{H}_6 \)), de donde deriva su nombre. Es un gas incoloro, tóxico, con un olor repulsivo y dulce que se enciende espontáneamente al entrar en contacto con el aire, produciendo una llama verde.
En realidad, el diborano posee una estructura revolucionaria, bastante diferente del etano. Al centro de la molécula, existen dos puentes «B-H-B». En cada uno de estos puentes, un par de electrones es compartido entre tres átomos. Los químicos denominan a estas interacciones como enlaces de «tres centros y dos electrones» (3c-2e).
Historia del diborano
La extrema toxicidad y reactividad del diborano lo hicieron problemático en sus primeros estudios. Inicialmente, los químicos propusieron fórmulas como \( \text{BH}_3 \) y \( \text{B}_3 \text{H}_3 \). Alrededor de 1912, un químico alemán llamado Alfred Stock comenzó a investigar el diborano y compuestos relacionados. Él dedujo la fórmula correcta: \( \text{B}_2 \text{H}_6 \). Un inconveniente fue la tendencia del diborano a reaccionar con los dobles enlaces \( \text{C=C} \) en la grasa utilizada para unir vidriería. Stock tuvo que inventar nuevo equipo para completar sus experimentos.
La fórmula \( \text{B}_2 \text{H}_6 \) planteó un importante dilema que se convertiría en un obstáculo para la teoría del enlace covalente. Ningún diagrama de puntos y cruces tenía sentido, ya que no había suficientes electrones para que ambos átomos de boro tuvieran una capa externa completa.
En la edición de 1945 de su libro de texto, el futuro Premio Nobel Linus Pauling dedicó más de tres páginas a respaldar una estructura similar a la del etano. Pensaba en términos de una estructura deslocalizada, aunque no parecía muy convincente. En particular, las moléculas deslocalizadas tienden a ser coloridas, y el diborano es incoloro. Sorprendentemente, la famosa idea de Pauling fue desafiada por un estudiante de pregrado.
Desafio
Christopher Longuet-Higgins, entonces estudiante de pregrado en el Balliol College de la Universidad de Oxford, regresó tras las vacaciones de verano en 1942 con su solución. Había escrito en secreto un artículo en el que proponía lo que resultó ser la estructura correcta del diborano. Mostró su propuesta a su tutor, y juntos escribieron lo que se convertiría en un artículo de referencia en la química teórica.
La evidencia clave provino de la espectroscopía infrarroja, que revela las formas en que las moléculas pueden doblarse, estirarse y torcerse. El diborano absorbe radiación infrarroja a varias energías, pero la importante se encuentra a 412 cm⁻¹. Esta energía provocaba que la molécula se doblara alrededor de los dos átomos de hidrógeno puente.
Esto es análogo a la apertura y cierre de un libro alrededor de su lomo. Este tipo de flexión es imposible en la estructura tipo etano propuesta por Pauling. Más recientemente, un experimento llamado espectroscopía de resonancia magnética nuclear (RMN) confirmó que existen dos tipos diferentes de átomos de hidrógeno en el diborano. La estructura tipo etano de Pauling habría tenido solo un tipo.
Relevancia para la Química de nivel avanzado
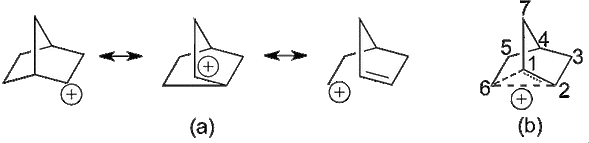
El enlace de tres centros y dos electrones (3c-2e), identificado por primera vez en el diborano, probablemente también se encuentra en los intermedios catiónicos formados durante ciertos mecanismos de reacción SN1. Un ejemplo bien estudiado es el catión 2-norbornilo. A pesar de sonar similar a «diborano», la parte «bornilo» del nombre se deriva de la isla de Borneo, hábitat del árbol del cual se pueden extraer compuestos relacionados.
Para sintetizar diborano (\( \text{B}_2\text{H}_6 \)), un enfoque ingenuo sería realizar una reacción análoga a la demostración común de silano.
Sin embargo, este método no funciona debido a que el diborano reacciona rápidamente con el agua y se destruye antes de llegar a la superficie:
Por lo tanto, el diborano debe ser sintetizado en un ambiente libre de agua. La síntesis más común en el laboratorio se lleva a cabo en un solvente orgánico seco llamado diglima, \( (\text{CH}_3 \text{OCH}_2 \text{CH}_2)_2 \text{O} \).
Diborano y los premio Nobel
La investigación relacionada con el diborano ganó el premio en 1976 y 1979. Uno de los químicos, Herbert C. Brown, de la Universidad de Purdue en Estados Unidos, investigó las reacciones entre el diborano y los hidrocarburos. Curiosamente, Brown investigó los tres elementos de sus iniciales: H, C y B.
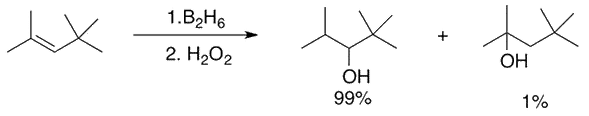
Recordando la molesta reacción secundaria de Alfred Stock, Brown descubrió una reacción llamada «hidroboración», que resulta útil para agregar agua a través de enlaces dobles \( \text{C=C} \). El grupo hidroxilo se une preferentemente al átomo de carbono más sustituido. Esta selectividad se denomina «adición anti-Markovnikov» y produce un resultado opuesto al método tradicional con \( \text{H}_3 \text{PO}_4 / \text{H}_2 \text{O} \).
Combustible de alta energia
La entalpía de combustión por gramo del diborano es mayor que la de cualquier otro combustible, con solo tres excepciones: \( \text{H}_2 \), \( \text{BeH}_2 \) y \( \text{Be(BH}_4 )_2 \).
En la década de 1970, la NASA investigó la combinación de diborano (\( \text{B}_2 \text{H}_6 \)) con difluoruro de oxígeno (\( \text{OF}_2 \)) como propelente para la etapa superior de cohetes. El diborano actuaba como combustible, mientras que el \( \text{OF}_2 \) era un agente oxidante muy potente.
El diborano puede calentarse a unos 200 °C para formar una familia de más de 25 compuestos de hidruro de boro, conocidos como «boranos», que son grandes moléculas tridimensionales en forma de jaula. Algunos boranos son líquidos o incluso sólidos a temperatura ambiente, lo que los hace combustibles prometedores. Los combustibles para aviones con aditivos en forma de boranos se conocen como «zip fuels» o «high energy fuel» (HEF).
En la década de 1950, el ejército de los Estados Unidos investigó el uso del pentaborano(9) (\( \text{B}_5 \text{H}_9 \), p.f. 60°C), como «supercombustible» para bombarderos de alta velocidad, misiles y cohetes. Fue conocido como «Green Dragon» debido al color de su llama.
El avión estadounidense XB-70 Valkyrie fue inicialmente diseñado para ser compatible con el combustible pentaborano(9). La reactividad de este compuesto llevó al abandono de su aplicación, pero no antes de que se almacenaran casi 1000 kg. No fue hasta el año 2000 cuando se desarrolló un método seguro y rentable para su eliminación. Este proceso, llamado «Dragon Slayer», implicaba la reacción del borano con agua:
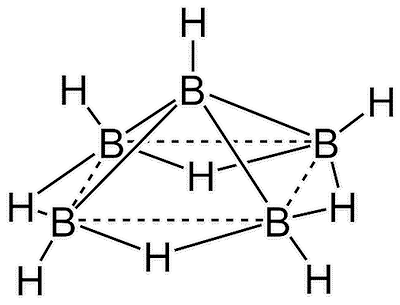
Jaulas de borano
A pesar de que los enlaces \( \text{H-B-H} \) en los puentes son de tres centros y dos electrones, sorprendentemente, son bastante fuertes, como se observa en la siguiente tabla:
| Enlace | Entalpía de enlace (kJ mol⁻¹) |
|---|---|
| B-H-B (puente) | 450 |
| B-H (terminal) | 375 |
Los datos de entalpía de enlace para el diborano son un buen ejemplo de por qué los estudiantes deben ser cuidadosos al utilizar entalpías de enlace «promedio» en sus cálculos. Esta sorprendente fortaleza de enlace permite al boro formar estas complejas estructuras en forma de jaula.
Existen tres principales series homólogas de boranos. Las jaulas que están completamente completas, con un átomo de boro en cada vértice de un poliedro, se llaman «closo-» y tienen la fórmula general \( [\text{B}_n \text{H}_n]^2- \). La eliminación de un átomo de boro de un vértice produce los nido-boranos (\( \text{B}_n \text{H}_{n+4} \)), de los cuales el diborano y el pentaborano(9) son miembros.
Estos tienen estructuras «en forma de nido», y «nido» proviene del latín para «nido». La eliminación de un segundo átomo de boro produce los arachno-boranos (\( \text{B}_n \text{H}_{n+6} \)), que tienen estructuras similares a una telaraña. «Arachno» proviene del griego para «araña». Los arachno-boranos son generalmente más reactivos y menos estables térmicamente que los nido-boranos.
Puntos de fusión y ebullición de los boranos:
| Borano | Punto de fusión (°C) | Punto de ebullición (°C) | Estabilidad en el aire |
|---|---|---|---|
| B₂H₆ | -164.85 | -92.59 | Explosivo |
| B₄H₁₀ | -120 | 18 | Reacciona lentamente |
| B₅H₉ | -46.8 | 60 | Inflamable espontáneamente |
| B₅H₁₁ | -122 | 65 | Inflamable espontáneamente |
| B₆H₁₀ | -62.3 | 108 | Reacciona lentamente |
| B₆H₁₂ | -82.3 | 80-90 | Reacciona rápidamente |
| B₁₀H₁₄ | 99.5 | 213 | Estable |
Para más información Diborane-D 6
Como citar este artículo:
APA: (2025-07-29). Diborano. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/diborano/
ACS: . Diborano. https://quimicafacil.net/compuesto-de-la-semana/diborano/. Fecha de consulta 2026-02-14.
IEEE: , "Diborano," https://quimicafacil.net/compuesto-de-la-semana/diborano/, fecha de consulta 2026-02-14.
Vancouver: . Diborano. [Internet]. 2025-07-29 [citado 2026-02-14]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/diborano/.
MLA: . "Diborano." https://quimicafacil.net/compuesto-de-la-semana/diborano/. 2025-07-29. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net