Tiempo de lectura estimado: 11 minutos
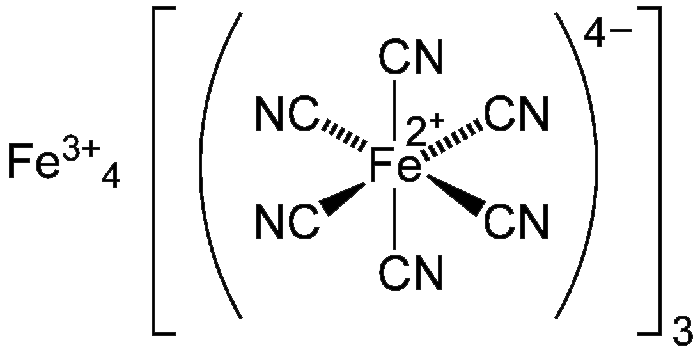
El azul de Prusia es un pigmento azul oscuro producido por la oxidación de sales de ferrocianuro ferroso. Tiene la fórmula química FeIII4[FeII(CN)6]3. Otro nombre para el color es el azul de Berlín o, en la pintura, el azul de París. El azul de Turnbull es la misma sustancia, pero está hecho de diferentes reactivos, y su color ligeramente diferente proviene de diferentes impurezas.
El azul de Prusia fue el primer pigmento sintético moderno. Se prepara como una dispersión coloidal muy fina, porque el compuesto no es soluble en agua. Contiene cantidades variables de otros iones y su aspecto depende sensiblemente del tamaño de las partículas coloidales. El pigmento se utiliza en pinturas, y es el «azul» tradicional en los planos y aizuri-e (藍摺り絵) impresiones japonesas de bloques de madera.
En medicina, el azul de Prusia administrado por vía oral se utiliza como antídoto para ciertos tipos de envenenamiento por metales pesados, por ejemplo, por el talio (I) y los isótopos radiactivos del cesio. La terapia aprovecha las propiedades de intercambio de iones del compuesto y su gran afinidad con ciertos cationes de metales «blandos».
El azul de Prusia presta su nombre al ácido prúsico (cianuro de hidrógeno) que se deriva de él. En alemán, el cianuro de hidrógeno se llama Blausäure («ácido azul»). El químico francés Joseph Louis Gay-Lussac dio su nombre al cianuro, del griego antiguo κύανος (kyanos, «azul»), por el color del azul de Prusia.
Historia del azul de Prusia
El pigmento azul de Prusia es significativo, ya que fue el primer pigmento azul estable y relativamente sólido a la luz que se utilizó ampliamente tras la pérdida de conocimientos sobre la síntesis del azul egipcio. Los pintores europeos habían utilizado anteriormente una serie de pigmentos como el tinte índigo, el esmalte y el púrpura tirio, que tienden a desvanecerse, y el ultramarino extremadamente caro hecho de lapislázuli. Los pintores japoneses y los grabadores de madera, igualmente, no tuvieron acceso a un pigmento azul de larga duración hasta que comenzaron a importar azul de Prusia de Europa.

El azul de Prusia Fe7(CN)18 (también (Fe4[Fe(CN)6]3) – xH2O) fue probablemente sintetizada por primera vez por el pintor Diesbach en Berlín alrededor de 1706. La mayoría de las fuentes históricas no mencionan un nombre de pila de Diesbach. Sólo Berger se refiere a él como Johann Jacob Diesbach.
Se cree que el pigmento se creó accidentalmente cuando Diesbach usó potasa contaminada con sangre para crear un tinte rojo de cochinilla. El tinte original requería potasa, sulfato férrico y cochinilla seca. En cambio, la sangre, la potasa y el sulfato de hierro reaccionaron para crear un compuesto conocido como ferrocianuro de hierro, que, a diferencia del pigmento rojo deseado, tiene un tono azul muy distintivo. Fue nombrado Preußisch blau y Berlinisch Blau en 1709 por su primer comerciante.
El pigmento sustituyó al costoso lapislázuli y fue un tema importante en las cartas intercambiadas entre Johann Leonhard Frisch y el presidente de la Academia de Ciencias de Prusia, Gottfried Wilhelm Leibniz, entre 1708 y 1716. Se menciona por primera vez en una carta escrita por Frisch a Leibniz, del 31 de marzo de 1708. A más tardar en 1708, Frisch comenzó a promover y vender el pigmento en toda Europa.
En agosto de 1709, el pigmento se denominó Preussisch blau; en noviembre de 1709, Frisch utilizó por primera vez el nombre alemán Berlinisch Blau. El propio Frisch es el autor de la primera publicación conocida del azul de Prusia en el periódico Notitia Coerulei Berolinensis nuper inventi en 1710, como se deduce de sus cartas. Diesbach había estado trabajando para Frisch desde aproximadamente 1701.
Primeros usos del azul de Prusia
Hasta la fecha, el Enterramiento de Cristo, fechado en 1709 por Pieter van der Werff (Pinacoteca, Sanssouci, Potsdam) es la pintura más antigua conocida en la que se usó el azul de Prusia. Alrededor de 1710, los pintores de la corte prusiana ya usaban el pigmento. Alrededor de la misma época, el azul de Prusia llegó a París, donde Antoine Watteau y más tarde sus sucesores Nicolas Lancret y Jean-Baptiste Pater lo usaron en sus pinturas.
En 1731, Georg Ernst Stahl publicó un relato de la primera síntesis del azul de Prusia. La historia involucra no sólo a Diesbach, sino también a Johann Konrad Dippel. Diesbach intentaba crear un pigmento rojo lacustre a partir de la cochinilla, pero obtuvo el azul en su lugar como resultado de la potasa contaminada que estaba usando. Tomó prestada la potasa de Dippel, que la había usado para producir su aceite animal. Ninguna otra fuente histórica conocida menciona a Dippel en este contexto. Por lo tanto, es difícil juzgar la fiabilidad de esta historia hoy en día. En 1724, la receta fue finalmente publicada por John Woodward.

Georg Ernst Stahl, publicó la primera síntesis del azul de Prusia
En 1752, el químico francés Pierre J. Macquer dio el importante paso de demostrar que el azul de Prusia podía reducirse a una sal de hierro y a un nuevo ácido, que podía utilizarse para reconstituir el colorante. El nuevo ácido, el cianuro de hidrógeno, aislado por primera vez del azul de Prusia en forma pura y caracterizado en 1782 por el químico sueco Carl Wilhelm Scheele, recibió finalmente el nombre de Blausäure (literalmente «ácido azul») debido a su derivación del azul de Prusia, y en inglés se conoció popularmente como Prussic acid. El cianuro, un anión incoloro que se forma en el proceso de fabricación del azul de Prusia, deriva su nombre de la palabra griega para azul oscuro.
Desde principios del siglo XVIII, el azul de Prusia era el color de abrigo predominante en los uniformes de los regimientos de infantería y artillería del ejército prusiano. Como Dunkelblau (azul oscuro), esta tonalidad alcanzó una importancia simbólica y continuó siendo usada por los soldados alemanes en ocasiones ceremoniales y fuera de servicio hasta el estallido de la Primera Guerra Mundial, cuando fue sustituida por el gris verdoso de campo (Feldgrau).
Síntesis
El azul de Prusia se produce por la oxidación de sales de ferrocianuro ferroso. Estos sólidos blancos tienen la fórmula M2Fe[Fe(CN)6] donde M+= Na+ o K+. El hierro en este material es todo férreo, de ahí la ausencia de color profundo asociado a la valencia mixta. La oxidación de este sólido blanco con peróxido de hidrógeno o clorato de sodio produce el ferricianuro y da el azul de Prusia.
Una forma «soluble», K[FeIIIFeII(CN)6], que es realmente coloidal, puede ser hecha de ferrocianuro de potasio y hierro(III):

La reacción similar del ferricianuro de potasio y el hierro (II) da como resultado la misma solución coloidal, porque el [FeIII(CN)6]3 se convierte en ferrocianuro.
El azul de Prusia «insoluble» se produce si, en las reacciones anteriores, se añade un exceso de Fe3+:
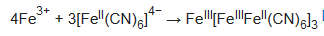
A pesar de que se prepara a partir de sales de cianuro, el azul de Prusia no es tóxico porque los grupos de cianuro están estrechamente ligados al hierro. Otros cianometalatos poliméricos son igualmente estables con una baja toxicidad.
El azul de Turnbull
En tiempos pasados, se pensaba que la adición de sales de hierro (II) a una solución de ferricianuro permitía obtener un material diferente del azul de Prusia. El producto se denominaba tradicionalmente el azul de Turnbull (TB). Sin embargo, los métodos de difracción de rayos X y de difracción de electrones han demostrado que las estructuras del PB y del TB son idénticas. Las diferencias en los colores del TB y del PB reflejan sutiles diferencias en los métodos de precipitación, que afectan fuertemente al tamaño de las partículas y al contenido de impurezas.
Propiedades del azul de Prusia
El azul de Prusia es un polvo azul microcristalino. Es insoluble, pero los cristalitos tienden a formar un coloide. Tales coloides pueden pasar a través de filtros finos. A pesar de ser uno de los más antiguos compuestos sintéticos conocidos, la composición del azul de Prusia permaneció incierta durante muchos años. Su identificación precisa se complicó por tres factores:
- El azul de Prusia es extremadamente insoluble, pero también tiende a formar coloides
- Las síntesis tradicionales tienden a dar lugar a composiciones impuras
- Incluso el azul de Prusia puro es estructuralmente complejo, desafiando la rutina del análisis cristalográfico
Color
El azul de Prusia es de un color fuerte y tiende al negro y al azul oscuro cuando se mezcla con pinturas al óleo. La tonalidad exacta depende del método de preparación, que dicta el tamaño de las partículas. El color azul intenso del azul de Prusia está asociado con la energía de la transferencia de electrones de Fe (II) a Fe (III). Muchos de estos compuestos de valencia mixta absorben ciertas longitudes de onda de luz visible resultantes de la transferencia de carga de intervalo. En este caso, se absorbe luz naranja-roja de unos 680 nanómetros de longitud de onda, y la luz reflejada aparece azul como resultado.

Al igual que la mayoría de los pigmentos de alto contenido cromático, el azul de Prusia no se puede visualizar con precisión en la pantalla de un ordenador. El azul de Prusia es electrocrómico y cambia de azul a incoloro al reducirse. Este cambio es causado por la reducción del Fe (III) a Fe (II), eliminando la transferencia de carga de intervalo que causa el color del azul de Prusia.
Usos
Arte
Debido a que es fácil de fabricar, barato, no tóxico y de color intenso, el azul de Prusia ha atraído muchas aplicaciones. Fue adoptado como pigmento muy poco después de su invención y se utilizó casi inmediatamente en el aceite, la acuarela y el teñido.
Los usos dominantes son los pigmentos: se producen anualmente unas 12.000 toneladas de azul de Prusia para su uso en tintas negras y azuladas. Una variedad de otros pigmentos también contiene el material. El azul de ingeniería y el pigmento formado en los cianotipos, lo que les da su nombre común de planos. Ciertos lápices de colores fueron una vez coloreados con azul de Prusia (más tarde re-etiquetado como azul de medianoche). También es un pigmento popular en las pinturas. Del mismo modo, el azul de Prusia es la base del azulado de lavandería.
Las nanopartículas de azul de Prusia se usan como pigmentos en algunos ingredientes de cosméticos según el Observatorio de Nanomateriales de la Unión Europea
Medicina
La capacidad del azul de Prusia para incorporar cationes metálicos monovalentes (Me+) lo hace útil como agente secuestrante de ciertos metales pesados tóxicos. El azul de Prusia de calidad farmacéutica se utiliza en particular para las personas que han ingerido talio (Tl+) o cesio radiactivo (134Cs+, 137Cs+).
Según el Organismo Internacional de Energía Atómica, un varón adulto puede ingerir al menos 10 g de azul de Prusia al día sin sufrir daños graves. La Administración de Alimentos y Medicamentos de los Estados Unidos ha determinado que «las cápsulas de 500 mg de azul de Prusia, cuando se fabrican en las condiciones de una solicitud de nuevo medicamento aprobada, pueden considerarse una terapia segura y eficaz» en ciertos casos de envenenamiento.
La radiogardasa (azul de Prusia en cápsulas solubles) es un producto comercial para la eliminación del cesio-137 del intestino, por lo tanto, indirectamente del torrente sanguíneo al intervenir en la circulación enterohepática del cesio-137, reduciendo el tiempo de residencia interna (y la exposición) en unos dos tercios. En particular, se utilizó para absorber 137Cs+ de los envenenados en el accidente de Goiânia.
Química analítica
El azul de Prusia se forma en el ensayo de azul de Prusia para los fenoles totales. A las muestras y patrones fenólicos se les da cloruro férrico ácido y ferricianuro, que se reduce a ferrocianuro por los fenoles. El cloruro férrico y el ferrocianuro reaccionan para formar el azul de Prusia. La comparación de la absorbancia a 700 nm de las muestras con los patrones permite determinar los fenoles o polifenoles totales.
Para más información Prussian Blue
Como citar este artículo:
APA: (2020-11-12). Azul de Prusia. Recuperado de https://quimicafacil.net/ciencia-y-arte/azul-de-prusia/
ACS: . Azul de Prusia. https://quimicafacil.net/ciencia-y-arte/azul-de-prusia/. Fecha de consulta 2026-02-17.
IEEE: , "Azul de Prusia," https://quimicafacil.net/ciencia-y-arte/azul-de-prusia/, fecha de consulta 2026-02-17.
Vancouver: . Azul de Prusia. [Internet]. 2020-11-12 [citado 2026-02-17]. Disponible en: https://quimicafacil.net/ciencia-y-arte/azul-de-prusia/.
MLA: . "Azul de Prusia." https://quimicafacil.net/ciencia-y-arte/azul-de-prusia/. 2020-11-12. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net