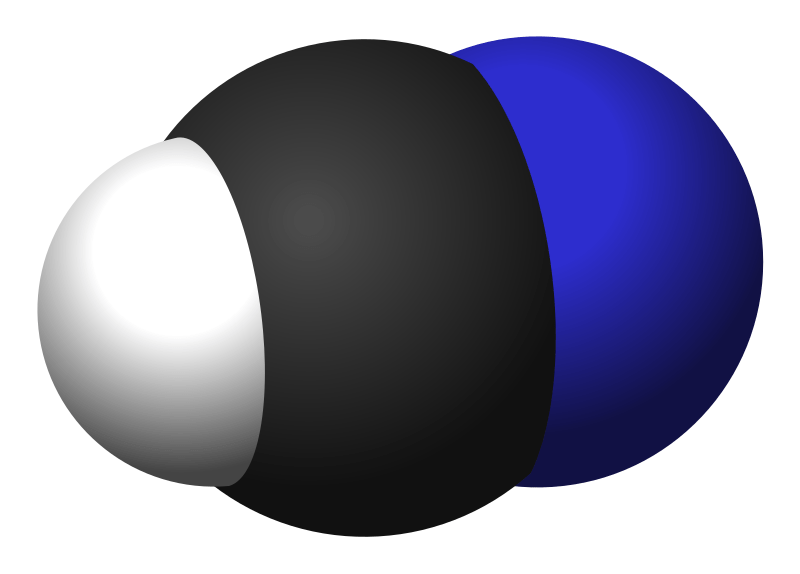Tiempo de lectura estimado: 10 minutos
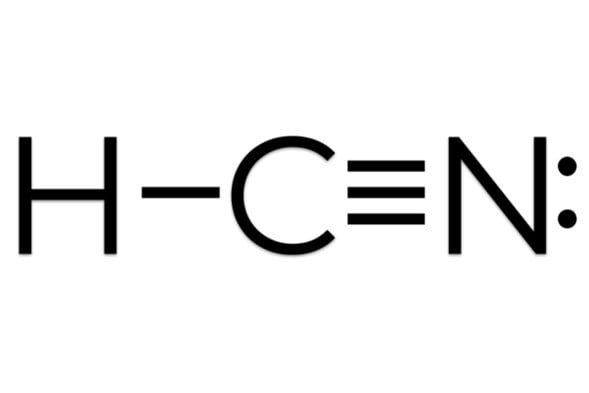
El cianuro de hidrógeno o ácido cianhídrico, a veces llamado ácido prúsico, es un compuesto químico con la fórmula HCN y la fórmula estructural H−C≡N.
Es un líquido incoloro, extremadamente venenoso e inflamable que hierve ligeramente por encima de la temperatura ambiente, a 25,6 °C (78,1 °F).
El HCN se produce a escala industrial y es un precursor altamente valorado para muchos compuestos químicos que van desde polímeros hasta productos farmacéuticos. Las aplicaciones a gran escala son para la producción de cianuro de potasio y adiponitrilo, utilizado en minería y plásticos, respectivamente. Es más tóxico que los compuestos de cianuro sólido debido a su naturaleza volátil.
Historia del cianuro de hidrógeno
Tan temprano como en 1706, J. Diesbach y J. Dippel descubrieron accidentalmente el azul de Prusia , un tinte azul en la reacción de sales de hierro con potasa de cal que contenía sales de hexacianoferrato , que se formaron en el tratamiento repetido del Tieröl de Dippel con potasa. Con un exceso de FeSO4 se obtenía un pigmento azul intenso insoluble . La primera publicación apareció en 1710 de forma anónima en la revista Miscellanea Berolinensia . Desde entonces, el azul de Prusia se convirtió en un gran éxito económico como tinte.
Solo en 1973, A. Ludi y otros lograron dilucidar la estructura del azul de Prusia puro: «Los resultados de los análisis químicos demuestran claramente que todas nuestras muestras tienen una composición cercana a la fórmula ideal FeIII4 [FeII(CN)6]3 · 15 H2O», mostrando Fe2+ y Fe3+ unidos por iones [CN]–.
Azul de Prusia como precursor del cianuro
Con la receta para la generación de azul de Prusia en mano, muchos alquimistas/químicos estudiaron sus propiedades y química. En 1782, el alquimista germano-sueco Karl Wilhelm Scheele obtuvo la Berlinerblausäure volátil (= ácido azul de Berlín, HCN) durante experimentos con azul de Prusia y prusiato amarillo mediante el tratamiento con ácido sulfúrico acuoso. Desde el descubrimiento de Scheele del HCN, se utilizó el nombre alemán Berlinerblausäure, sin embargo, a menudo se abreviaba a Blausäure (= ácido azul = ácido prúsico), que todavía se utiliza para el HCN en la lengua alemana hasta la fecha.
Fue Joseph Louis Gay-Lussac en 1815 quien introdujo el término francés cyanogène (derivado de la palabra griega para azul – ver arriba – y γεννάω, yo creo) para el radical [CN]·, que descubrió que era la entidad central en el ácido prúsico de acuerdo con el trabajo de C.-L. Berthollet. Por lo tanto, renombró el ácido prúsico como l’acide hydrocyanique (HCN, cianuro de hidrógeno; otros nombres comunes para el HCN: ácido cianhídrico, ácido prúsico). Además, J. L. Gay-Lussac observó la formación de diciano gaseoso, NC–CN, en el tratamiento térmico de dicianuro de mercurio.
Pseudohalogenos
Con la preparación de HCN por K. W. Scheele en 1782, se aislaron los primeros compuestos pseudohalógenos, aunque este término se introdujo más de 100 años después. El concepto de pseudohalógeno fue introducido por Lothar Birckenbach y Karl Kellermann en 1925 y posteriormente establecido y justificado en una serie de informes experimentales, así como aplicado y desarrollado por otros.
Curiosamente, el término fue introducido por L. Birckenbach y K. Kellermann «para evitar el término radical controvertido», por lo tanto, propusieron el término pseudoelemento en estado libre. Dado que el radical [CN]· se comporta químicamente como un halógeno, lo llamaron pseudohalógeno. Al igual que todos los pseudohaluros, el ion cianuro representa un monoanión estabilizado por resonancia monovalente.
El ion diatómico [CN]– es el más simple de todos los pseudohaluros (como [N3]–, [OCN]–, [SCN]–, [CNO]–, etc.). Debido al mayor número de átomos que forman el pseudohaluro, por lo general se observan radios iónicos más grandes y diferentes propiedades estéricas en comparación con los haluros. Además, a diferencia de los haluros, el cianuro, con su carácter ambidentado con respecto a la unión, puede formar enlaces dativos ya sea a través del átomo de nitrógeno o del átomo de carbono o incluso a través de ambos en un modo de coordinación 1,2-puente. El modo de puente también se conoce en haluros.
Similitud con los halógenos
Sin embargo, hay una serie de propiedades químicas que son muy similares a las de los halógenos. Por ejemplo, el cianuro cumple los siguientes criterios con respecto a un comportamiento químico similar al de un halógeno: forma (i) un radical univalente [CN]· fuertemente unido, (ii) un anión con carga única ([CN]–), (iii) un ácido de hidrógeno (HCN, ácido cianhídrico), (iv) sales del tipo M(CN)n con sales de plata, plomo y mercurio, que presentan una baja solubilidad, (v) un compuesto dipseudohalógeno neutro (NC-CN), que se desproporciona en agua (en [CN]– y [OCN]–) y se puede agregar a dobles enlaces (lo cual no es el caso de NC-CN sino de HCN), y (vi) especies interpseudohalógeno así como compuestos halógeno-pseudohalógeno (X-CN).
Recientemente, se ha demostrado que este concepto se puede ampliar por el criterio de que un pseudohalógeno también debe formar un ion pseudohalón, por ejemplo, en el caso de CN del tipo [TMS-CN-TMS]+. Además, el radical cianuro es, al igual que los radicales halógenos, una molécula fuertemente electronegativa, con una afinidad electrónica medida de (3,862 ± 0,004) eV.
Síntesis de cianuro de hidrógeno
La gran demanda de cianuros para las explotaciones mineras en la década de 1890 fue satisfecha por George Thomas Beilby, que patentó en 1892 un método para producir cianuro de hidrógeno haciendo pasar amoníaco sobre carbón incandescente. Este método se utilizó hasta que, en 1894, Hamilton Castner desarrolló una síntesis a partir de carbón, amoníaco y sodio para producir cianuro sódico, que reacciona con el ácido para formar HCN gaseoso.
El cianuro de hidrógeno se forma en cantidades limitadas a partir de muchas combinaciones de hidrógeno, carbono y amoníaco. Actualmente, se produce en grandes cantidades mediante varios procesos, así como también se recupera como residuo de la fabricación de acrilonitrilo. En 2006, se produjeron entre 500 millones y 1 billón de libras (entre 230,000 y 450,000 t) en los Estados Unidos.
Procesos industriales
El proceso más importante es la oxidación de Andrussow, inventada por Leonid Andrussow en IG Farben, en la que el metano y el amoníaco reaccionan en presencia de oxígeno a aproximadamente 1,200 °C (2,190 °F) sobre un catalizador de platino. Otro método involucra la reacción del cianuro de sodio con ácido sulfúrico. La energía necesaria para la reacción la proporciona la oxidación parcial del metano y el amoníaco.
De menor importancia es el proceso Degussa (proceso BMA), en el que no se añade oxígeno y la energía debe transferirse indirectamente a través de la pared del reactor. Esta reacción es similar al reformado con vapor, la reacción del metano y el agua para dar monóxido de carbono e hidrógeno.
En el Proceso Shawinigan, los hidrocarburos, por ejemplo, el propano, reaccionan con amoníaco. En el laboratorio, se producen pequeñas cantidades de HCN añadiendo ácidos a sales de cianuro de metales alcalinos. Esta reacción es a veces la base de intoxicaciones accidentales porque el ácido convierte una sal de cianuro no volátil en el HCN gaseoso.
Aplicaciones y fuentes naturales
El HCN es el precursor del cianuro de sodio y del cianuro de potasio, que se utilizan principalmente en la minería de oro y plata y en la galvanoplastia de estos metales. A través de la intermediación de cianohidrinas, se preparan una variedad de compuestos orgánicos útiles a partir de HCN, incluyendo el monómero metil metacrilato, a partir de acetona, el aminoácido metionina, a través de la síntesis de Strecker, y los agentes quelantes EDTA y NTA. A través del proceso de hidrocianación, se agrega HCN al butadieno para dar adiponitrilo, un precursor del Nylon-6,6.
El HCN se utiliza globalmente como fumigante contra muchas especies de insectos plagas que infestan las instalaciones de producción de alimentos. Tanto su eficacia como su método de aplicación conducen a que se utilicen cantidades muy pequeñas del fumigante en comparación con otras sustancias tóxicas utilizadas para el mismo propósito. El uso de HCN como fumigante también tiene un impacto ambiental mínimo en comparación con moléculas fumigantes estructuralmente similares, como el fluoruro de sulfuryl y el bromuro de metilo.
Cianuro en semillas y raíces
El HCN se puede obtener de frutas que tienen una semilla, como cerezas, albaricoques, manzanas y almendras amargas, a partir de las cuales se produce aceite de almendra y saborizantes. Muchas de estas semillas contienen pequeñas cantidades de cianohidrinas como mandelonitrilo y amigdalina, que liberan lentamente cianuro de hidrógeno. Cien gramos de semillas de manzana trituradas pueden producir alrededor de 70 mg de HCN.
Las llamadas raíces «amargas» de la planta de yuca pueden contener hasta 1 gramo de HCN por kilogramo. Algunos milpiés, como Harpaphe haydeniana, Desmoxytes purpurosea y Apheloria, liberan cianuro de hidrógeno como mecanismo de defensa, al igual que ciertos insectos, como las polillas quemadas y las larvas de Paropsisterna eucalyptus. El cianuro de hidrógeno se encuentra en el escape de los vehículos y en el humo de la combustión de plásticos que contienen nitrógeno.
Cianuro fuera de la tierra
El HCN ha sido detectado en el medio interestelar y en las atmósferas de estrellas de carbono. Desde entonces, estudios extensos han investigado las vías de formación y destrucción del HCN en diversos entornos y han examinado su uso como trazador de una variedad de especies y procesos astronómicos. El HCN se puede observar desde telescopios terrestres a través de varias ventanas atmosféricas. Se han observado las transiciones rotacionales puras J=1→0, J=3→2, J=4→3 y J=10→9.
El HCN se forma en las nubes estelares a través de dos vías principales: mediante una reacción neutra-neutra y mediante recombinación disociativa. La recombinación disociativa es dominante en un 30%; sin embargo, el HCNH+ debe estar en su forma lineal. La recombinación disociativa con su isómero estructural, H2NC+, produce exclusivamente isocianuro de hidrógeno.
El HCN se destruye en las nubes interestelares a través de varios mecanismos dependiendo de la ubicación en la nube. En regiones fotodominadas, la fotodisociación domina, produciendo CN. A mayores profundidades, la fotodisociación por rayos cósmicos domina, produciendo CN. En el núcleo oscuro, dos mecanismos compiten para destruirlo, formando HCN+ y HCNH+. La reacción con HCO+ domina por un factor de ~3,5. El HCN se ha utilizado para analizar una variedad de especies y procesos en el medio interestelar.
En agosto de 2014, los astrónomos publicaron estudios detallando la distribución de HCN, HNC, H2CO y polvo dentro de las comas de los cometas C/2012 F6 (Lemmon) y C/2012 S1 (ISON), utilizando el Atacama Large Millimeter/Submillimeter Array (ALMA) por primera vez.
En febrero de 2016, se anunció que se encontraron trazas de cianuro de hidrógeno en la atmósfera de la súper-Tierra caliente 55 Cancri e con el telescopio espacial Hubble de la NASA.
Titán
El HCN ha sido medido en la atmósfera de Titán por cuatro instrumentos en la sonda espacial Cassini, un instrumento en Voyager y un instrumento en la Tierra. Una de estas mediciones fue in situ, donde la nave espacial Cassini se sumergió entre 1,000 y 1,100 km sobre la superficie de Titán para recolectar gas atmosférico para el análisis de espectrometría de masas.
El HCN se forma inicialmente en la atmósfera de Titán a través de la reacción de metano y radicales de nitrógeno producidos fotoquímicamente, que proceden a través del intermedio H2CN, por ejemplo, (CH3 + N → H2CN + H → HCN + H2). La radiación ultravioleta descompone el HCN en CN + H; sin embargo, el CN se recicla eficientemente de vuelta a HCN a través de la reacción CN + CH4 → HCN + CH3.
Para más información Main group cyanides: from hydrogen cyanide to cyanido-complexes
Como citar este artículo:
APA: (2023-08-22). Cianuro de hidrógeno. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/cianuro-de-hidrogeno/
ACS: . Cianuro de hidrógeno. https://quimicafacil.net/compuesto-de-la-semana/cianuro-de-hidrogeno/. Fecha de consulta 2024-07-27.
IEEE: , "Cianuro de hidrógeno," https://quimicafacil.net/compuesto-de-la-semana/cianuro-de-hidrogeno/, fecha de consulta 2024-07-27.
Vancouver: . Cianuro de hidrógeno. [Internet]. 2023-08-22 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/cianuro-de-hidrogeno/.
MLA: . "Cianuro de hidrógeno." https://quimicafacil.net/compuesto-de-la-semana/cianuro-de-hidrogeno/. 2023-08-22. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net