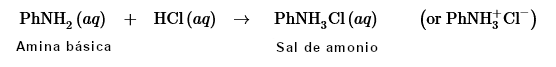Tiempo de lectura estimado: 10 minutos
Una modificación de las extracciones previamente discutidas consiste en realizar una reacción química en el embudo de separación para cambiar la polaridad y, por tanto, la partición de un compuesto en las capas acuosa y orgánica. Un método común es realizar una reacción ácido-base, que puede convertir algunos compuestos de formas neutras a iónicas (o viceversa).
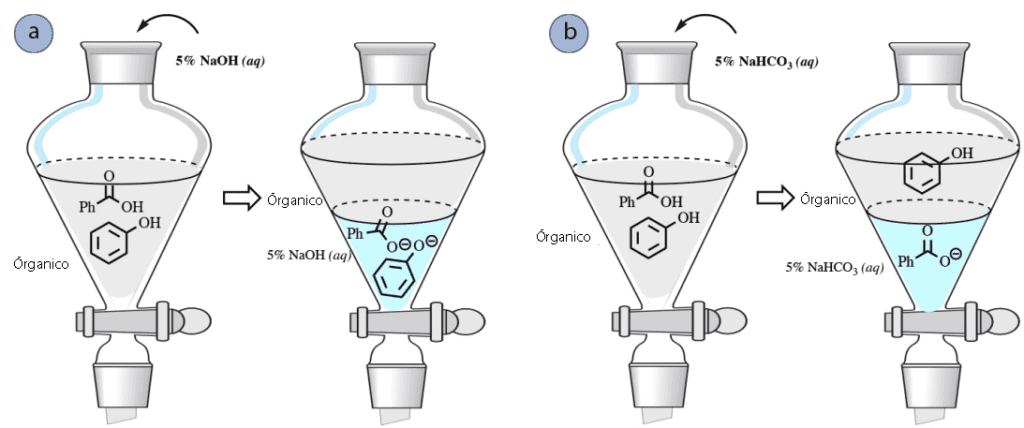
Por ejemplo, imagine que una mezcla de ácido benzoico y ciclohexano se disuelve en un disolvente orgánico como el acetato de etilo en un embudo de separación. Para separar los componentes, se puede intentar un lavado con agua para eliminar el ácido benzoico, pero éste no es particularmente soluble en agua debido a su anillo aromático no polar, y sólo se extraerían pequeñas cantidades en la capa acuosa (Figura 1a).

Sin embargo, es posible separar una mezcla de ácido benzoico y ciclohexano mediante un lavado con una base como el NaOH. Debido a su naturaleza ácida, el ácido benzoico puede sufrir una reacción con el NaOH de la siguiente manera, dando lugar a la sal carboxilato benzoato de sodio.
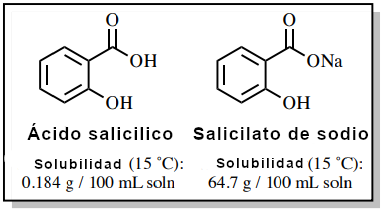
Las propiedades de solubilidad de los ácidos carboxílicos son sustancialmente diferentes a las de sus correspondientes sales de carboxilato. El salicilato de sodio es aproximadamente 350 veces más soluble en agua que el ácido salicílico debido a su carácter iónico (Figura 2), y es bastante insoluble en disolventes orgánicos como el éter dietílico.
Por lo tanto, un lavado con NaOH convertiría el ácido benzoico en su forma de carboxilato iónico, que entonces sería más soluble en la capa acuosa, permitiendo que el benzoato de sodio se extrajera en la capa acuosa. El ciclohexano permanecería en la capa orgánica ya que no tiene afinidad por la fase acuosa, ni puede reaccionar con el NaOH de ninguna manera. De esta manera, se puede separar una mezcla de ácido benzoico y ciclohexano (Figura 1b). La capa acuosa puede acidificarse posteriormente con HCl(aq) si se desea para convertir el ácido benzoico de nuevo en su forma neutra.
Lavados con bicarbonato de sodio
Se puede utilizar una extracción ácido-base para extraer los ácidos carboxílicos de la capa orgánica a la capa acuosa. Como se discutió en la sección anterior, el NaOH puede utilizarse para convertir un ácido carboxílico en su forma de carboxilato iónico más soluble en agua. Sin embargo, si la mezcla contiene un compuesto deseado que puede reaccionar con el NaOH, debe utilizarse una base más suave, como el bicarbonato de sodio. Se produce una reacción similar:
Una diferencia al utilizar la base NaHCO3 en lugar de NaOH es que el subproducto ácido carbónico (H2CO3) puede descomponerse en agua y gas carbónico. Cuando se agita una solución ácida con bicarbonato de sodio en un embudo de separación, se debe tener cuidado de agitar suavemente y ventilar con más frecuencia para liberar la presión del gas.
Un ejemplo de una reacción que a menudo utiliza el lavado con bicarbonato de sodio en el trabajo es una reacción de esterificación de Fischer. Para demostrarlo, el ácido benzoico se sometió a reflujo en etanol junto con ácido sulfúrico concentrado para formar benzoato de etilo (Figura 3a+b). Una placa de TLC de la mezcla de reacción a 1 hora de reflujo mostró ácido carboxílico residual sin reaccionar (Figura 3c), lo que no es raro debido a la energética de la reacción.

El ácido carboxílico residual puede eliminarse del producto éster deseado mediante una extracción ácido-base en un embudo de separación. Un lavado con bicarbonato sódico convierte el ácido benzoico en su forma más hidrosoluble de benzoato sódico, extrayéndolo en la capa acuosa (Figura 4). Además, el bicarbonato sódico neutraliza el ácido catalítico en esta reacción.
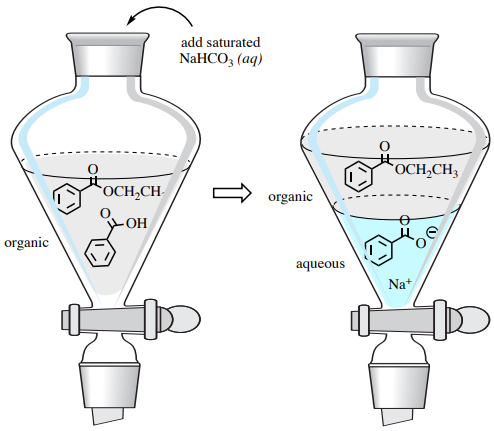
El bicarbonato de sodio es preferible al NaOH en este proceso, ya que es una base mucho más débil; el lavado con NaOH podría causar la hidrólisis del producto de éster.
Mezclas de ácidos y bases
Como se ha comentado anteriormente, las propiedades ácido-base de los compuestos pueden utilizarse para extraer selectivamente determinados compuestos de las mezclas. Esta estrategia puede extenderse a otros ejemplos.
Extracción de bases
Los compuestos básicos, como las aminas, pueden extraerse de las soluciones orgánicas agitándolas con soluciones ácidas para convertirlas en sales más solubles en agua. De este modo, pueden extraerse de una capa orgánica a una capa acuosa.
Extracción de ácidos carboxílicos frente a fenoles
Como se ha comentado anteriormente, los ácidos carboxílicos pueden extraerse de una capa orgánica a una acuosa agitándolos con soluciones básicas, lo que los convierte en sus sales más solubles en agua.
Una reacción similar ocurre con los fenoles (PhOH), y también pueden ser extraídos en una capa acuosa de NaOH (Figura 5a).
Sin embargo, los fenoles son considerablemente menos ácidos que los ácidos carboxílicos, y no son lo suficientemente ácidos como para reaccionar completamente con NaHCO3
una base más débil. Por lo tanto, se puede utilizar una solución de bicarbonato para separar las mezclas de fenoles y ácidos carboxílicos (Figura 5b).
Extracción de compuestos ácidos, básicos y neutros
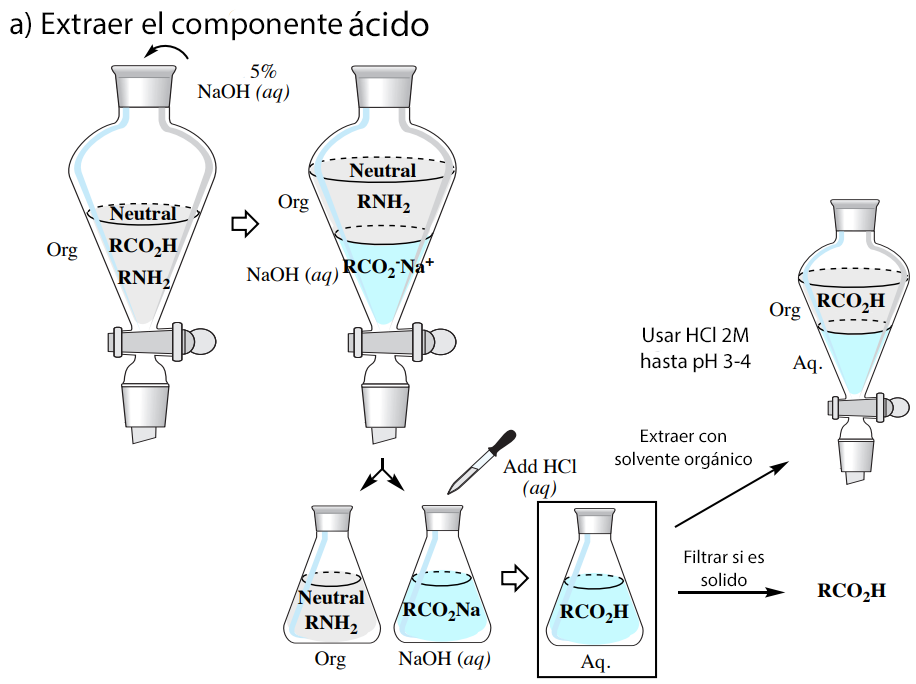
Las propiedades ácido-base comentadas anteriormente permiten purificar una mezcla que contenga componentes ácidos (por ejemplo, RCO2H), básicos (por ejemplo, RNH2) y neutros a través de una serie de extracciones, como se resume en la Figura 6 (que utiliza un disolvente orgánico menos denso que el agua).
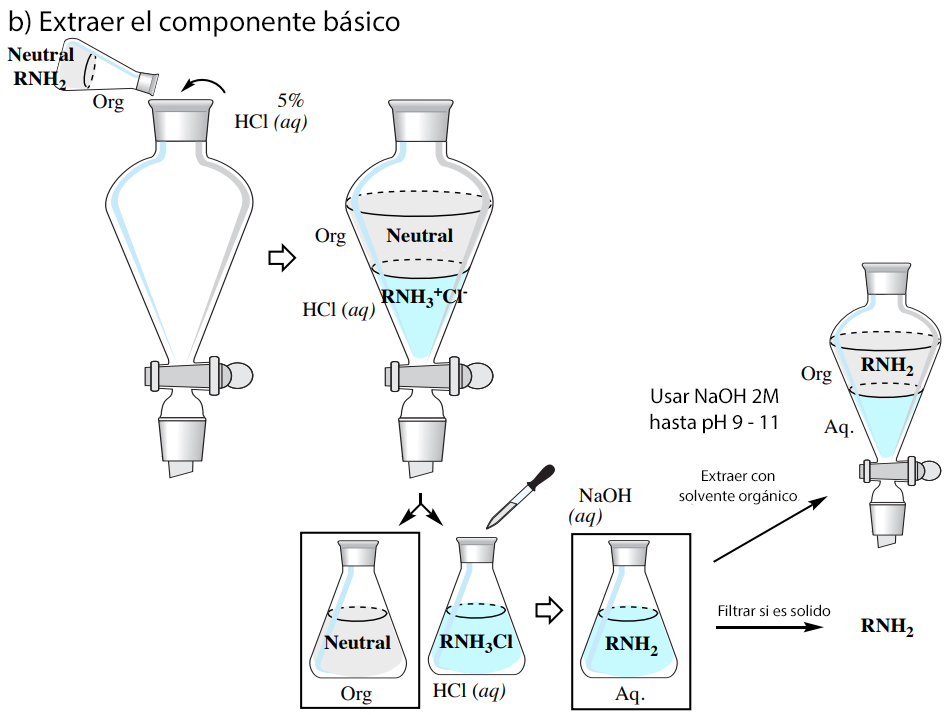
Se supone que los lectores que realizan este tipo de experimento están familiarizados con la realización de extracciones simples y múltiples. En esta sección se describen las diferencias entre los procedimientos generales de extracción y el proceso resumido en la Figura 6.
Aislamiento del componente ácido:
Cuando el componente ácido se encuentra en la capa acuosa de un matraz Erlenmeyer, puede volver a convertirse en el componente neutro mediante la adición de 2MHCl(aq) hasta que la solución dé un pH de 3-4 (determinado con papel de pH). Si hay grandes cantidades de ácido y la acidificación requiere un volumen demasiado grande de 2MHCl(aq), puede añadirse gota a gota HCl(aq) concentrado. Las concentraciones más bajas de HCl(aq) son menos peligrosas, pero el aumento del volumen de la capa acuosa en una gran cantidad afectaría a la eficacia de las extracciones y los pasos de filtrado posteriores.
Después de la acidificación, se pueden tomar dos rutas, dependiendo de si el componente ácido es sólido o líquido.
Si se forma un sólido al acidificar la sal iónica, puede recogerse mediante filtración por succión. Este método sólo debe utilizarse si se observan grandes cantidades de cristales de gran tamaño. Si se forman cristales finos (que son bastante comunes), obstruirán el papel de filtro e interferirán con el drenaje adecuado. En caso de sólo observar una pequeña cantidad de sólidos en comparación con la cantidad teórica, es probable que el compuesto sea bastante soluble en agua, y la filtración conduciría a una baja recuperación.
Si no se forma ningún sólido tras la acidificación (o si se forman cristales finos o poca cantidad de sólidos), extraiga el componente ácido de nuevo en un disolvente orgánico (×3). Como regla general, utilice un tercio de la cantidad de disolvente para las extracciones que la capa original (por ejemplo, si utiliza 100mL de solución acuosa, extraiga con 33mL de disolvente orgánico cada vez). Asegúrese de enfriar primero la solución acuosa en un baño de hielo antes de la extracción si la acidificación creó un calor notable. Siga con un lavado con salmuera (×1) si utiliza éter dietílico o acetato de etilo, seque con un agente secante y elimine el disolvente mediante un evaporador rotatorio para dejar el componente ácido puro.
Aislamiento del componente básico:
Utilice un proceso similar al del aislamiento del componente ácido, excepto que basifique la solución utilizando 2M NaOH(aq) hasta que dé un pH de 9-10 determinado por el papel de pH.
Aislamiento del componente neutro:
El componente neutro será el compuesto «sobrante» de la capa orgánica. Para aislarlo, lavar con salmuera (×1) si se utiliza éter dietílico o acetato de etilo, secar con un agente desecante y eliminar el disolvente mediante un evaporador rotatorio para dejar el componente neutro puro.
Para más información Acid-Base Extraction
Como citar este artículo:
APA: (2022-03-30). Extracción ácido – base. Recuperado de https://quimicafacil.net/tecnicas-de-laboratorio/extraccion-acido-base/
ACS: . Extracción ácido – base. https://quimicafacil.net/tecnicas-de-laboratorio/extraccion-acido-base/. Fecha de consulta 2026-01-29.
IEEE: , "Extracción ácido – base," https://quimicafacil.net/tecnicas-de-laboratorio/extraccion-acido-base/, fecha de consulta 2026-01-29.
Vancouver: . Extracción ácido – base. [Internet]. 2022-03-30 [citado 2026-01-29]. Disponible en: https://quimicafacil.net/tecnicas-de-laboratorio/extraccion-acido-base/.
MLA: . "Extracción ácido – base." https://quimicafacil.net/tecnicas-de-laboratorio/extraccion-acido-base/. 2022-03-30. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net