Tiempo de lectura estimado: 9 minutos
Los baños de enfriamiento permiten disminuir la temperatura de una sustancia o solución por debajo de la temperatura ambiente.
Existen tanto técnicas como equipos especializados para realizar enfriamiento en el laboratorio de química, aunque todos aprovechan distintas propiedades termodinámicas de los materiales.
Se utilizan los baños de enfriamiento ampliamente en la química orgánica por una variedad de razones. La baja temperatura de estos baños está determinada tanto por el uso apropiado del disolvente como por un agente criogénico como el nitrógeno líquido, el hielo seco (CO2) o el hielo.
La mayoría de estos métodos requieren un monitoreo continuo para asegurar que la temperatura se mantenga estable. Para un uso prolongado o no monitorizado, puede ser mejor invertir en un crioenfriador. Se pueden obtener temperaturas entre -20 y -80° utilizando mezclas criogénicas variadas de etilenglicol y etanol sobre hielo seco.
Los usos de los baños de enfriamiento son diversos. Se pueden emplear para disminuir la perdida de volátiles en el producto de una destilación especialmente sensible, también para evitar reacciones de polimerización de ciertos reactivos que son fomentadas por la temperatura o para controlar la velocidad de una reacción altamente exotérmica como por ejemplo una nitración orgánica.
Consideraciones generales
Un baño de enfriamiento, en la práctica de química de laboratorio, es una mezcla líquida que se utiliza para mantener bajas temperaturas, normalmente entre 13 °C y -196 °C. Estas bajas temperaturas se utilizan para recoger líquidos después de la destilación, para eliminar disolventes mediante un evaporador rotativo o para realizar una reacción química por debajo de la temperatura ambiente.
Los baños de enfriamiento son generalmente de dos tipos: (a) un fluido frío (particularmente nitrógeno líquido, agua, o incluso aire) – pero más comúnmente el término se refiere a (b) una mezcla de 3 componentes: 1) un agente refrigerante (como el hielo seco o el hielo acuoso); 2) un «soporte» líquido (como el agua líquida, el etilenglicol, la acetona, etc.), que transfiere calor entre el baño y el recipiente; ; y 3) un aditivo para deprimir el punto de fusión del sistema sólido/líquido.
Un ejemplo conocido de esto es el uso de una mezcla de hielo y cloruro de sodio para enfriar. La adición de sal reduce la temperatura de congelación del agua, disminuyendo la temperatura mínima alcanzable sólo con hielo.
Baños de Enfriamiento Mixtos por Solventes
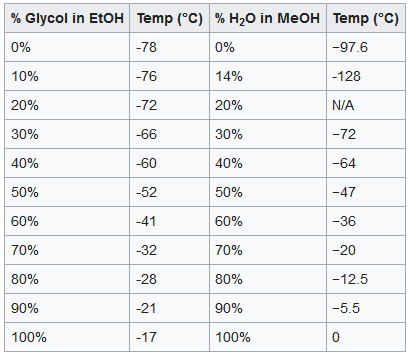
La mezcla de disolventes crea baños de enfriamiento con puntos de congelación variables. Se pueden mantener temperaturas entre -78 °C y -17 °C aproximadamente colocando refrigerante en una mezcla de etilenglicol y etanol, mientras que las mezclas de metanol y agua abarcan el intervalo de temperaturas de -128 °C a 0 °C. El hielo seco se sublima a -78 °C, mientras que el nitrógeno líquido se utiliza para los baños más fríos.
A medida que el agua o el etilenglicol se congelan fuera de la mezcla, la concentración de etanol/metanol aumenta. Esto lleva a un nuevo punto de congelación inferior. Con hielo seco, estos baños nunca se congelarán, ya que el metanol puro y el etanol se congelan por debajo de -78 °C (-98 °C y -114 °C, respectivamente).
En comparación con los baños de enfriamiento tradicionales, las mezclas de disolventes son adaptables a un amplio rango de temperaturas. Además, los disolventes necesarios son más baratos y menos tóxicos que los utilizados en los baños tradicionales.
Baños de enfriamiento tradicionales
Baños de agua y hielo
Un baño de hielo y agua mantendrá una temperatura de 0 °C, ya que el punto de fusión del agua es de 0 °C. Sin embargo, la adición de una sal como el cloruro de sodio reducirá la temperatura a través de la propiedad de la depresión del punto de congelación.
Aunque la temperatura exacta puede ser difícil de controlar, la relación de peso de la sal y el hielo influye en la temperatura, por ejemplo:
- -10 °C con una relación de 1 a 2,5 en peso de cloruro de calcio hexahidratado a hielo.
- -20 °C con una relación de 1 a 3 en peso de cloruro de sodio y hielo.
- -40 °C con una relación de 1 a 0,8 en peso de hexahidrato de cloruro de calcio con respecto al hielo.
Baños de hielo seco a -78 °C
Dado que el hielo seco se sublima a -78 °C, una mezcla como la acetona/hielo seco mantendrá -78 °C. Además, la solución no se congela porque la acetona requiere una temperatura de aproximadamente -93 °C para empezar a congelarse. Por lo tanto, otros líquidos con un punto de congelación más bajo (pentano: -95 °C, alcohol isopropílico: -89 °C) también pueden utilizarse para mantener el baño a -78 °C.
Baños de hielo seco por encima de -77 °C
Para mantener las temperaturas por encima de -77 °C, se debe utilizar un disolvente con un punto de congelación superior a -77 °C. Cuando se añade hielo seco al acetonitrilo, el baño comienza a enfriarse. Una vez que la temperatura alcanza los -41 °C, el acetonitrilo se congela. Por lo tanto, el hielo seco debe añadirse lentamente para evitar que se congele toda la mezcla. En estos casos, se puede alcanzar una temperatura de baño de -55 °C eligiendo un disolvente con un punto de congelación similar (el n-octano se congela a -56 °C).
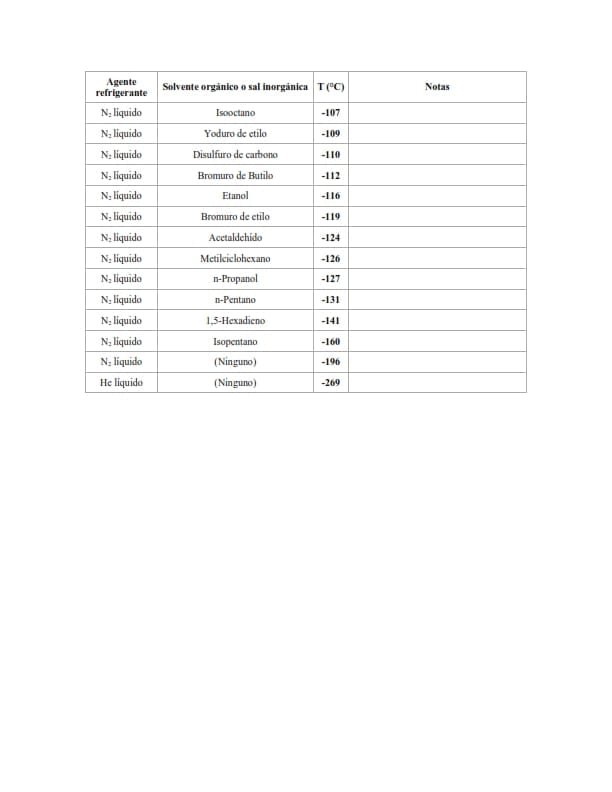
Baños de nitrógeno líquido por encima de -196 °C
Los baños de nitrógeno líquido siguen la misma idea que los baños de hielo seco. Se puede mantener una temperatura de -115 °C añadiendo lentamente nitrógeno líquido al disolvente orgánico (etanol) hasta que comience a congelarse (el etanol se congela a -116 °C).
Alternativas al agua y hielo
En los baños a base de agua y hielo, el agua del grifo se utiliza comúnmente debido a la facilidad de acceso y a los costos más altos del uso de agua ultrapura. Sin embargo, el agua del grifo y el hielo derivado del agua del grifo pueden ser un contaminante para las muestras biológicas y químicas. Esto ha creado una gran cantidad de dispositivos aislados destinados a crear un efecto de enfriamiento o congelación similar al de los baños de hielo sin el uso de agua o hielo.
Paso a paso para hacer un baño de enfriamiento
A continuación se dará un esquema general paso a paso para el montaje de un baño de enfriamiento en el laboratorio. Las cantidades de solventes o agentes enfriadores empleados dependerá de la mezcla criogénica escogida según la temperatura deseada, pero la mayoría de los pasos serán similares.
- Determine la cantidad de mezcla criogénica que necesita. Es recomendable emplear un recipiente o frasco Dewar para almacenar la mezcla criogénica para disminuir la trasmisión de calor del ambiente. Este recipiente tendrá un volumen determinado, se recomienda preparar suficiente mezcla para la mitad o 2/3 del volumen del recipiente.
- Escoger la temperatura que se desea del baño de enfriamiento. dependiendo de las sustancias en la mezcla criogénica y de sus porcentajes, se obtendrá una temperatura aproximada en el baño. Por ejemplo, si se necesita una temperatura -20°C y se escoge una mezcla criogénica metanol/agua es necesario hacer una mezcla 70/30 de estos solventes. Para preparar 100 mL de mezcla criogénica se requerirá 70 mL de etanol y 30 mL de agua.
- Moler con ayuda de un martillo o una espátula fuerte 10 g de hielo seco. El hielo seco ayudará a bajar y mantener la temperatura del baño de enfriamiento.
- Mezcla 70 mL de metanol y 30 mL de agua en un erlenmeyer, transferir la mitad de la mezcla al frasco Dewar.
- Adicionar lentamente el hielo seco a la mezcla criogénica en el frasco Dewar, se observará la formación de burbujas y niebla al momento de entra en contacto el hielo seco con la mezcla. Remover la mezcla con ayuda de una espátula. El hielo seco debe mantenerse sin evaporarse, pero la mezcla no debe solidificarse.
- Agregar el resto de la solución metanol/agua al frasco Dewar. El hielo seco remanente deberá evaporarse. Medir la temperatura en la mezcla criogénica que debe estar alrededor de -20 ± 5°C.
- Agregar un pequeño trozo de hielo seco. Después de unos cinco minutos, se formará una capa de hielo alrededor del hielo seco, lo que indica que se encuentra a la temperatura deseada.
- Cuando el baño de enfriamiento comience a calentarse, esta capa flotará en la superficie, y es hora de añadir otro trozo de hielo seco.
- Puede realizarse el mismo procedimiento, pero con nitrógeno líquido, sin embargo, requerirá de una agitación mecánica constante para evitar la formación de zonas frías.
Nota de seguridad: el manejo de sustancias y mezclas criogénicas debe realizarse con mucha precaución. Se debe utilizar guantes gruesos y gafas de seguridad en todo momento, no manipular el hielo seco con las manos desnudas. No se debe adicionar hielo seco en grandes cantidades ya que el cambio de fase puede ser violento y generar una explosión.
Recomendaciones de seguridad
La American Chemical Society señala que los disolventes orgánicos ideales para utilizar en un baño de enfriamiento tienen las siguientes características:
- Vapores no tóxicos
- Baja viscosidad
- No inflamabilidad
- Baja volatilidad
- Punto de congelación adecuado
En algunos casos, una simple sustitución puede dar resultados casi idénticos a la vez que reduce los riesgos. Por ejemplo, el uso de hielo seco en 2-propanol en lugar de acetona produce una temperatura casi idéntica, pero evita la volatilidad de la acetona.
Lista de mezclas criogénicas para baños de enfriamiento
Existe una gran cantidad de mezclas criogénicas que permite obtener una gran surtido de mezclas criogénicas que se pueden preparar en el laboratorio. A continuación encontraran listados con los más comunes.
Lista de baños de enfriamiento para descargar
Baños de enfriamiento – lista (1495 descargas )Más información Cooling Baths
Como citar este artículo:
APA: (2021-01-27). Baños de enfriamiento. Recuperado de https://quimicafacil.net/tecnicas-de-laboratorio/banos-de-enfriamiento/
ACS: . Baños de enfriamiento. https://quimicafacil.net/tecnicas-de-laboratorio/banos-de-enfriamiento/. Fecha de consulta 2026-02-27.
IEEE: , "Baños de enfriamiento," https://quimicafacil.net/tecnicas-de-laboratorio/banos-de-enfriamiento/, fecha de consulta 2026-02-27.
Vancouver: . Baños de enfriamiento. [Internet]. 2021-01-27 [citado 2026-02-27]. Disponible en: https://quimicafacil.net/tecnicas-de-laboratorio/banos-de-enfriamiento/.
MLA: . "Baños de enfriamiento." https://quimicafacil.net/tecnicas-de-laboratorio/banos-de-enfriamiento/. 2021-01-27. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net