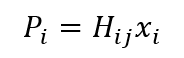Tiempo de lectura estimado: 9 minutos
La ley de Henry es parte importante de la fisicoquímica moderna. Se utiliza en todas las ramas de la ciencia en las que la solubilidad de un gas en un líquido es un fenómeno importante.
No obstante, muchas personas se sorprenden de la antigüedad de la ley de Henry. La ley de Henry es tan antigua como la ciencia de la química moderna. En su forma más simple, la ley de Henry afirma que la solubilidad de un gas en un líquido es proporcional a la presión parcial del gas.
donde P, es la presión parcial del componente i en el gas; Hij es la constante de la ley de Henry para el soluto i en el disolvente j y xi es la fracción molar del componente i en el líquido. A menudo se utilizan otras unidades de concentración para la fase líquida (por ejemplo, molaridad, molalidad y fracción de peso).
Las raíces de la química moderna
A principios del siglo XIX, la ciencia de la química estaba en pañales. La mayoría de los historiadores de la ciencia marcan el inicio de la química moderna con la caída de la teoría del flogisto a finales del siglo XVIII. Guiada por Antoine Lavoisier en Francia y otros en Europa, la nueva ciencia fue tomando forma poco a poco. William Henry, que da nombre a la ley, pertenecía a esta generación de químicos.
La publicación de la Ley de Henry
En diciembre de 1802, las observaciones experimentales de William Henry fueron presentadas a la Royal Society de Londres. Henry estudió el efecto de la presión sobre la solubilidad de algunos gases en el agua. Aunque su aparato era tosco y sus materiales probablemente impuros, llegó a una conclusión audaz y general. Afirmó:
...el agua absorbe, del gas condensado por una, dos o más atmósferas adicionales, una cantidad que, ordinariamente comprimida, equivaldría al doble, triple, etc. del volumen absorbido bajo la presión común de la atmósfera.
Aunque el lenguaje es un poco anticuado, este es un enunciado reconocible de la ley de Henry. La constante de proporcionalidad implícita en este enunciado se denominó constante de Henry. Es interesante observar que el mismo Henry aceptaba que la ley no se cumplía estrictamente.
Mediante la repetición frecuente de los experimentos, obtuve resultados que difieren del principio general arriba expuesto; pero para todos los fines prácticos, aprecio que la ley ha sido anunciada con suficiente exactitud.
Además, el agua fue el único disolvente que Henry examinó. Hoy en día, la ley se aplica de alguna forma a prácticamente todos los disolventes.
A lo largo del siglo XIX los investigadores trataron de demostrar o refutar la ley de Henry. Se examinaron muchos solutos y solventes diferentes. A finales del siglo XIX, la ley era generalmente aceptada, aunque quedaban algunas excepciones. De hecho, muchos investigadores incorporaron la ley en sus experimentos. Las solubilidades de los gases se medían a una presión cercana a la atmosférica y los valores se comunicaban a 1 atm tras ser corregidos mediante la ley de Henry. Esta práctica continuó en el siglo XX.
Los inconformistas y la aplicación de la ciencia
Henry fue contemporáneo de famosos científicos británicos como Joseph Priestley y John Dalton. Muchos de estos científicos eran inconformistas. Eran protestantes, es decir, no eran miembros de la Iglesia de Inglaterra. La mayoría se negaba a jurar lealtad, por lo que sus libertades estaban restringidas. Como no se les permitía entrar en las grandes escuelas de Inglaterra, fundaron sus propias escuelas. Enseñaban ciencias y oficios, además de su religión.
Los inconformistas eran, en general, industriales, no estrictamente científicos. Sus actividades científicas solían ser aplicadas y no puras. Por ejemplo, los científicos no conformistas estudiaban química y no astronomía.
Fueron los inconformistas quienes impulsaron la Revolución Industrial en Gran Bretaña. Los nobles y la alta burguesía cedieron gustosamente estos trabajos industriales a los inconformistas. Muchos inconformistas se enriquecieron vendiendo bienes materiales a la clase alta. No es de extrañar que los inconformistas procedieran de centros industriales como Birmingham y Manchester y no de Londres, el centro intelectual y cultural de Inglaterra.
El padre de la ley
William Henry fue aprendiz de Thomas Percival y más tarde trabajó con John Ferriar y John Huit en la Manchesters Infirmary. Comenzó a estudiar medicina en Edimburgo en 1795, obteniendo el título de médico en 1807, pero una mala salud interrumpió su práctica como médico, y se dedicó principalmente a la investigación química, especialmente en lo que respecta a los gases.
Uno de sus trabajos más conocidos (publicado en Philosophical Transactions of the Royal Society, 1803) describe experimentos sobre la cantidad de gases absorbidos por el agua a diferentes temperaturas y bajo diferentes presiones. Sus resultados se conocen hoy como la ley de Henry. Sus otros trabajos tratan del análisis de gases, la humedad del fuego, el gas de iluminación, la composición del ácido clorhídrico y del amoníaco, las concreciones urinarias y otras concreciones mórbidas, y el poder desinfectante del calor. Su obra Elements of Experimental Chemistry (1799) estuvo muy de moda en su época y tuvo once ediciones en 30 años. Fue uno de los fundadores del Instituto de Mecánica que se convertiría en el Instituto de Ciencia y Tecnología de la Universidad de Manchester.
Fue elegido miembro de la Royal Society en febrero de 1809, tras haber recibido su prestigiosa medalla Copley en 1808.
Se suicidó en su capilla privada de Pendlebury, cerca de Manchester, en 1836.
Su hermano mayor era también un científico de cierta reputación. Thomas Henry descubrió que una planta sometida a un entorno de dióxido de carbono puro perecería, mientras que en una mezcla diluida en dióxido de carbono prosperaba mejor que en el aire puro. El hijo de William Henry, William C. Henry, escribió una famosa biografía de John Dalton. De ahí que a menudo se confunda el padre con el hijo.
La ley de las presiones parciales de Dalton y la ley de Henry
Uno de los amigos íntimos de Henry era John Dalton. Dalton era un maestro de escuela cuáquero. También fue miembro de la Sociedad de Manchester, de la que fue presidente durante un tiempo . Propuso su famosa teoría atómica casi al mismo tiempo que Henry presentó su ley. Los principios de Dalton fueron presentados a lo largo de un periodo de diez años que comenzó en 1802.
Como parte de estas teorías, Dalton propuso la ley de la presión parcial. Como muchos aspectos de las teorías de Dalton, esta ley fue muy criticada al principio. Henry, que inicialmente se oponía a esta ley, fue uno de los primeros conversos. Dalton presentó un documento a la Sociedad de Manchester que se haría famoso. Aunque la ponencia versaba sobre las solubilidades de los gases, su fama se debe a que se adjuntó a esta ponencia la primera tabla de Dalton de pesos relativos (ahora llamados masas molares).
Sin embargo, en este trabajo Dalton demostró que la solubilidad de los componentes individuales en una mezcla gaseosa dependía de su presión parcial. Dalton razonó que la solubilidad de cada componente de una mezcla gaseosa era independiente de los demás componentes del gas. Henry llegó a la conclusión de que Dalton tenía razón. La solubilidad de un componente gaseoso en una mezcla dependía únicamente de su propia presión «parcial». Esta es la forma de la ley de Henry que se utiliza más a menudo hoy en día.
El desarrollo del equilibrio de fases
En el ámbito de los cálculos del comportamiento de las fases, el modelo de Henry llegó mucho antes que sus rivales. No fue hasta 1875 cuando J. Willard Gibbs, un físico estadounidense, formuló de forma elocuente la teoría matemática que subyace al equilibrio de fases.
El documento On the Heterogeneous Equilibria of Substances es un hito científico. En él, Gibbs aplica los principios de la termodinámica para obtener soluciones a los problemas de la química. De este modo, Gibbs fue el primero en unir dos ciencias hasta entonces separadas.
Más de 80 años después de que Henry publicara su ley, François-Marie Raoult, un químico francés, publicó sus descubrimientos sobre las presiones de vapor de las soluciones, que ahora llamamos ley de Raoult. Las leyes de Henry y Raoult están tan relacionadas, en su sentido moderno, que suelen enseñarse al mismo tiempo a los estudiantes de fisicoquímica. Sin embargo, sus publicaciones están separadas por más de tres cuartos de siglo desde el punto de vista histórico.
A principios del siglo XX, Gilbert Lewis, un químico estadounidense, postuló una nueva magnitud termodinámica: la fugacidad. El uso de la fugacidad facilitó considerablemente la aplicación de los principios de Gibbs a los problemas físicos.
Los conceptos de Henry, Raoult, Gibbs y Lewis siguen siendo las piedras angulares de los cálculos modernos de equilibrio de fases. En cierta forma, estas teorías siguen utilizándose hoy en día. Ahora disponemos de mejores modelos y métodos de cómputo que hacen que estos cálculos sean más prácticos, pero la teoría subyacente no ha cambiado.
La ley de Henry se propuso al principio de la era de la química moderna, lo cual es sorprendentemente temprano, y la ley sigue siendo muy popular hoy en día. A partir de la primera y la segunda ley de la termodinámica y sus consecuencias, la ley de Henry puede extenderse teóricamente a condiciones que van más allá del alcance del sencillo aparato de Henry.
Para más información Henry’s Law: A Historical View
Como citar este artículo:
APA: (2021-08-19). La ley de Henry. Recuperado de https://quimicafacil.net/notas-de-quimica/la-ley-de-henry/
ACS: . La ley de Henry. https://quimicafacil.net/notas-de-quimica/la-ley-de-henry/. Fecha de consulta 2026-02-27.
IEEE: , "La ley de Henry," https://quimicafacil.net/notas-de-quimica/la-ley-de-henry/, fecha de consulta 2026-02-27.
Vancouver: . La ley de Henry. [Internet]. 2021-08-19 [citado 2026-02-27]. Disponible en: https://quimicafacil.net/notas-de-quimica/la-ley-de-henry/.
MLA: . "La ley de Henry." https://quimicafacil.net/notas-de-quimica/la-ley-de-henry/. 2021-08-19. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net