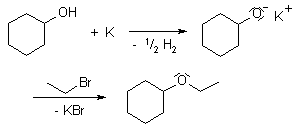Tiempo de lectura estimado: 4 minutos
La síntesis de Williamson o la síntesis de éteres de Williamson, es una reacción de acoplamiento desarrollada por el químico ingles Alexander Williamson en 1850. Su importancia radica en su sencillez y es ampliamente usada en industria y laboratorio para la obtención de éteres simétricos y asimétricos.
Fundamentos de la síntesis de Williamson
La síntesis de Williamson es una reacción orgánica basada en el mecanismo de reacción SN2 partiendo de un haloalcano primario y un alcóxido.
El alcóxido puede ser primario, secundario o terciario, pero se prefiere que el haloalcano sea primario, ya que un haloalcano secundario o terciario son propensos a provocar reacciones indeseadas.
Debido a la alta reactividad de los alcóxidos, generalmente son preparados justo para la reacción empleando una base como hidróxido de potasio. La elección del solvente es primordial para la velocidad de reacción, ya que solventes próticos y polares disminuyen la velocidad de reacción.
Materiales
- Montaje para reflujo (balón de fondo plano, condensador de bolas)
- Soporte universal
- Pinzas
- Probeta de 25 mL
- Plancha de calentamiento
- Pipeta graduada de 10 mL
- Pipeteador o propipeta
- 2 vasos de precipitado de 250 mL
- Equipo de filtración al vacío (matraz Kitasato, embudo Buchner)
- Papel filtro
- Desecador a vacío
- Balanza analítica
Reactivos
- 2 naftol
- Hidróxido de sodio
- Etanol
- yodobutano
Procedimiento – Síntesis de Williamson
Tiempo necesario: 3 horas
Procedimiento Síntesis de Williamson
En un balón de fondo redondo de 100 mL colocar 1 g de 2-naftol y 0,56 g de hidróxido de sodio en lentejas.
AnuncioAñadir 20 mL de etanol y poner en reflujo hasta mezcla total.
Detener el calentamiento y dejar enfriar. Añadir al sistema 1 mL de yodobutano y volver a iniciar el reflujo por espacio de 1 a 2 horas.
Completado el tiempo de reflujo, detener el calentamiento y dejar enfriar.
Colocar el balón en un baño de hielo hecho en un vaso de precipitados de 250 mL. Observar la formación de un precipitado blanco.
AnuncioFiltrar al vacío tarando previamente el papel filtro a emplear. Lavar con 30 mL de agua helada y dejar secar al aire por 15 minutos.
Retirar el papel filtro con el producto y dejar en el desecador a vacío por 24 horas.
Pesar el producto y calcular el rendimiento de la reacción.
Después del experimento
Plantear la reacción de síntesis y realizar los cálculos estequiométricos para determinar el reactivo limite. Calcular el rendimiento de la reacción con base a la masa medida al final del experimento.
Plantear un posible mecanismo de la reacción empleada en la experiencia.
Plantear un método para la caracterización e identificación del producto obtenido y su pureza.
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información Williamson Synthesis
Como citar este artículo:
APA: (2019-07-17). Síntesis de Williamson. Recuperado de https://quimicafacil.net/manual-de-laboratorio/sintesis-de-williamson/
ACS: . Síntesis de Williamson. https://quimicafacil.net/manual-de-laboratorio/sintesis-de-williamson/. Fecha de consulta 2026-02-27.
IEEE: , "Síntesis de Williamson," https://quimicafacil.net/manual-de-laboratorio/sintesis-de-williamson/, fecha de consulta 2026-02-27.
Vancouver: . Síntesis de Williamson. [Internet]. 2019-07-17 [citado 2026-02-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/sintesis-de-williamson/.
MLA: . "Síntesis de Williamson." https://quimicafacil.net/manual-de-laboratorio/sintesis-de-williamson/. 2019-07-17. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net