Tiempo de lectura estimado: 5 minutos
La reacción de Reimer–Tiemann es una reacción orgánica empleada para convertir un fenol a un orto hidroxil-benzaldehido empleando cloroformo, una base y un ácido. El mecanismo comienza con la sustracción del protón del cloroformo con una base para formar un triclorocarbanión que espontáneamente pierde un ion cloruro para formar un diclorocarbeno neutral.
La base también deprotona el fenol que entonces ataca al carbeno, y que, después de sucesivas etapas de reacción resultan en la aparición del producto.
Fundamento de la reacción de Reimer – Tiemann
La reacción de Reimer-Tiemann es una reacción química empleada para la formilación de fenoles. Fue descubierta por los químicos alemanes Karl Reimer y Ferdinand Tiemann en 1876.
El mecanismo de reacción es largo e involucra varias etapas de reacción sucesivas. El cloroformo se desprotona por la presencia de una base fuerte formando un carbanión. Este carbanión sufre de eliminación alfa originando un diclorocarbeno.
El hidróxido también desprotona al fenol, generando un fenóxido de carga negativa. Esta carga negativa se deslocaliza en el anillo aromático lo que hace que la selectividad de la reacción sea en posición orto.
El diclorocarbeno ataca al fenol para formar un intermediario diclorometilfenol, que se hidroliza generando el producto final.
La formilación de compuestos aromáticos puede ser realizada empleando otras alternativas como la reacción Gattermann, la reacción Gattermann-Koch o la reacción de Duff, aunque la reacción de Reimer-Tiemann es preferida debido a que no requiere ácidos fuertes o condiciones anhidras.
Materiales
- Erlenmeyer de 250 mL
- Condensador
- Balón de fondo redondo de 3 bocas de 100 mL
- Sistema de filtración al vacío
- Cristalizador
- Vaso de precipitado de 500 mL
- Agitador magnético
- Plancha de calentamiento
- Pipeta graduada de 10 mL
- Probeta de 100 mL
- Termómetro
Reactivos
- Fenol
- Cloroformo
- Hidróxido de sodio
- Acido sulfúrico concentrado
- Bisulfito de sodio
- Sulfato de magnesio anhidro
- Éter etílico
- Etanol
- n- butanol
- permanganato de potasio
- anhidrido acético
Procedimiento
Tiempo necesario: 2 horas
Procedimiento de Reacción de Reimer–Tiemann
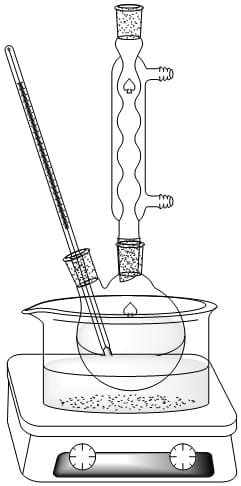
Realizar el siguiente montaje de reacción en reflujo con un agitador magnético, el termómetro debe quedar a dos centímetros del fondo del matraz.

En el balón colocar una solución de 8 g de hidróxido de sodio y 8 mL de agua destilada, calentar suavemente hasta lograr disolver la mayor parte del hidróxido. Manteniendo la agitación, agregar una solución de 2,5 g de fenol en 2,5 mL de agua a través del embudo de adición. Ajustar la temperatura del balón a 60 – 65°C calentando a baño de María.
AnuncioAdicionar cuidadosamente 4 mL de cloroformo dividido en tres porciones (1,5 – 1,5 – 1 mL) en intervalos de 15 minutos por la parte superior del condensador. Aumentar la temperatura hasta ebullición del agua por espacio de una hora.
Dejar enfriar el sistema y acidificar el contenido del balón de reacción (debe ser de color naranja) empleando ácido sulfúrico diluido.
Realizar un montaje de destilación de arrastre con vapor para extraer el orto-salicilaldehído. Detener la extracción cuando no se observe condensación de líquido de aspecto oleoso.

Transferir el orto-salicilaldehído obtenido a un embudo de decantación y extraer 3 veces con 5 mL de éter. Recolectar los extractos etéreos en un erlenmeyer de 50 mL y evaporar el éter calentando el erlenmeyer con agua tibia o en Rotavaporador.
AnuncioAl solido obtenido agregar el doble de volumen de una solución saturada de bisulfito de sodio y agitar vigorosamente por media hora. Dejar en reposo por media hora y filtrar empleando filtración al vacío, lavando con etanol y éter sucesivamente.
El solido recuperado se coloca en un balón de fondo redondo y se calienta a baño de María, con un poco de acido sulfúrico diluido. Dejar enfriar y añadir un poco de éter, secar con sulfato de magnesio anhidro. Evaporar el éter en baño de maría o Rotavaporador. Si se desea purificar el salicilaldehído se puede destilar en el rango de 195 – 197 °C.
Después del experimento
Escribir el mecanismo de la reacción empleada en el experimento y correlacionar cada procedimiento de laboratorio con la etapa o las etapas del mecanismo de reacción.
Proponer un procedimiento para comprobar la naturaleza del compuesto obtenido y su pureza.
Recomendaciones de seguridad
La evaporación de éter debe realizarse en un ambiente abierto o en una cabina de extracción de gases si no se cuenta con equipo de rotavaporación.
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Mayor información
Summary: Synthesis of Salicylaldehyde and its Applications
Clasificación
Nivel: Universitario
Tipo: Practica de enseñanza
Riesgo: medio
Como citar este artículo:
APA: (2019-07-31). Reacción de Reimer–Tiemann. Recuperado de https://quimicafacil.net/manual-de-laboratorio/reaccion-de-reimer-tiemann/
ACS: . Reacción de Reimer–Tiemann. https://quimicafacil.net/manual-de-laboratorio/reaccion-de-reimer-tiemann/. Fecha de consulta 2026-02-17.
IEEE: , "Reacción de Reimer–Tiemann," https://quimicafacil.net/manual-de-laboratorio/reaccion-de-reimer-tiemann/, fecha de consulta 2026-02-17.
Vancouver: . Reacción de Reimer–Tiemann. [Internet]. 2019-07-31 [citado 2026-02-17]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/reaccion-de-reimer-tiemann/.
MLA: . "Reacción de Reimer–Tiemann." https://quimicafacil.net/manual-de-laboratorio/reaccion-de-reimer-tiemann/. 2019-07-31. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net