Tiempo de lectura estimado: 9 minutos
El cobre fue quizás el primer metal producido y utilizado por el ser humano. Un colgante de cobre descubierto en el norte de Irak podría haberse fabricado hace más de 10.000 años. Las culturas nativas del medio oeste americano utilizaban el cobre hace 6.000 años. Se sabe que existían minas de cobre en Egipto hace al menos 3.000 años.
El cobre es un material extremadamente importante en la sociedad moderna. El metal tiene una gran conductividad eléctrica y térmica, es resistente a la corrosión (oxidación) y puede mezclarse con otros metales para formar aleaciones. El latón se forma a partir de una mezcla de cobre y zinc. El bronce se forma a partir de cobre y estaño. En Estados Unidos se utiliza el cobre a razón de 7.300 millones de libras (3,3 millones de toneladas métricas) al año.
Los efectos medioambientales de la minería del cobre son importantes. En el proceso de extracción se pueden liberar metales tóxicos en las fuentes de agua dulce.
El cobre es un recurso lo suficientemente valioso como para ser reciclado en gran medida. Aproximadamente el 40% del cobre se recicla en Estados Unidos.
Estados de oxidación del cobre
En la naturaleza se encuentran dos formas de óxido de cobre, el óxido de cobre (I) (oxido cuproso) y el óxido de cobre (II) (oxido cúprico).
Los óxidos de cobre pueden convertirse en cobre metálico por reacción con hidrógeno molecular o con monóxido de carbono a alta temperatura:
El gas hidrógeno puede producirse añadiendo un ácido fuerte, como el ácido sulfúrico, al zinc metálico. La reacción es rápida si la concentración de ácido sulfúrico es alta y la superficie del zinc metálico es grande.
Formula empírica
La fórmula empírica de un compuesto es la relación de números enteros más simple de los átomos del compuesto. Por ejemplo, la fórmula empírica de la glucosa es CH2O. Esto significa que hay 1 átomo de carbono por 2 átomos de hidrógeno por 1 átomo de oxígeno en una molécula de glucosa. La fórmula empírica es útil porque puede utilizarse para determinar la fórmula molecular de un compuesto. La fórmula molecular da el número real de átomos en una molécula de un compuesto. Para la glucosa, la fórmula molecular es C6H12O6. Si los subíndices de la fórmula molecular de la glucosa se dividen entre 6, el resultado es la fórmula empírica (CH2O).
Para determinar la fórmula empírica de un compuesto necesitamos conocer la masa de cada elemento en una muestra del compuesto.
Materiales
- 2 tubos de ensayo limpios y secos
- 2 vasos de precipitado de 100 mL
- Frasco para reactivos
- Tubo de Thiestle
- Tubos de vidrio
- Tapones con un agujero
- Mechero Bunsen
- Soporte universal
- 2 pinzas para tubo de ensayo
- Balanza analítica
Reactivos
- Zinc en granallas
- Ácido sulfúrico 3M
- Oxido de cobre (I o II)
Procedimiento
Utilizando una balanza analítica digital para medir la masa de un tubo de ensayo limpio y seco.
Añadir entre 1.300 g y 2.000 g de polvo de óxido de cobre al tubo de ensayo y vuelve a medir la masa del del tubo.
Obtenga unos 60 mL de solución de ácido sulfúrico en un vaso de precipitados de 100 mL.
Montar el aparato generador de hidrógeno descrito a continuación.
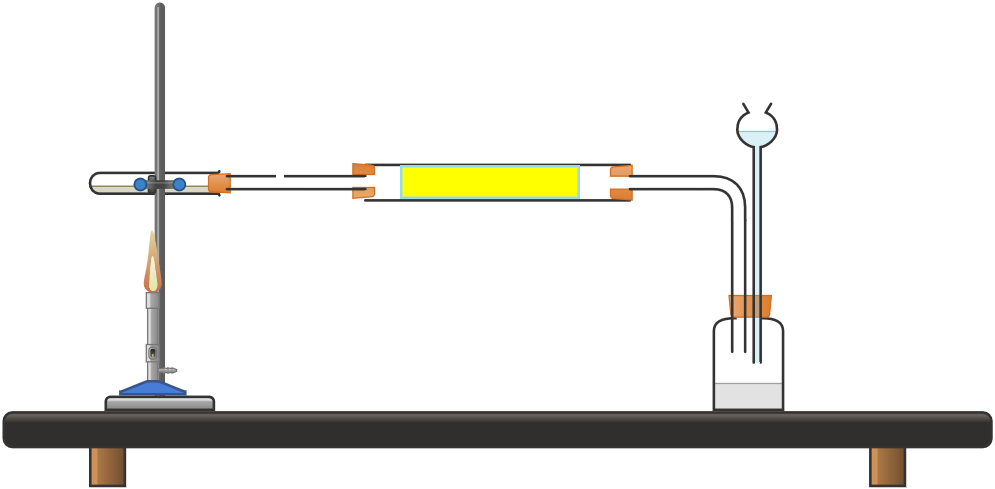
La figura de la derecha muestra el aparato experimental aparato utilizado para reducir el óxido de cobre. Los componentes importantes de componentes importantes son:
- Mechero Bunsen con manguera de gas
- Tubo de ensayo que contiene óxido de cobre.
- Tubo de secado.
- Generador de hidrógeno con zinc
- Tubo de Thistle y embudo para transferir ácido sulfúrico.
El generador de gas hidrógeno con tubo de cardo se utiliza para producir gas hidrógeno. El ácido sulfúrico se vierte en el embudo y baja por el tubo de Thistle. Utilice un limpiador de tuberías, si es necesario, para eliminar el agua en el sistema entre el tubo de secado y la punta de la boquilla. Todas las conexiones deben ser firmes. El tubo de ensayo debe estar sujeto justo en la boca y debe tener una muy ligera inclinación hacia abajo en la boca para permitir que el agua fluya lejos del óxido de cobre. El óxido de cobre debe quedar confinado en la mitad posterior del tubo y no ser tocado por el tubo largo.
Generando el hidrógeno gaseoso
Encienda el mechero Bunsen. No empiece a calentar la muestra todavía.
Vierte lentamente entre la mitad y los dos tercios de los 60 mL de ácido sulfúrico 3 M (H2SO4) en el tubo de Thiele. A medida que el ácido sulfúrico oxida el zinc metálico, debe haber un gas burbujeante visible en la botella del generador.
El ácido sulfúrico debe añadirse lentamente para que la mezcla no burbujee a través del tubo de Thiele. La reacción produce una gran cantidad de calor y puede hervir el agua en la solución de ácido sulfúrico, por lo que añadir lentamente disminuirá la probabilidad de que la solución burbujee fuera del embudo.
Verificando la generación de hidrógeno
El tubo de vidrio que está conectado a al tubo de ensayo está provisto de una abertura que permite que el exceso de hidrógeno fluya fuera del sistema. Esta abertura también puede estar en la parte inferior del tubo de ensayo. Este hidrógeno que sale del sistema puede encenderse y quemarse recogiendo parte de él con un tubo de ensayo pequeño y encendiendo después el gas recogido con el mechero Bunsen. Si el tubo de ensayo se devuelve rápidamente a la abertura de desbordamiento, el calor generado también puede encender el hidrógeno que sale por la abertura.
Continúe añadiendo el ácido sulfúrico en el tubo de Thiele a medida que avanza la reacción.
Coloque un tubo de ensayo invertido en la boquilla durante unos 5-10 segundos. A continuación, retire rápidamente el tubo y acérquelo a la llama y coloque la abertura del tubo en el borde de la llama. Es posible que se produzca un sonido de estallido suave o fuerte. Si es así, vuelve a colocar el tubo en el tubo de rebose y enciende el hidrógeno que sale por la abertura.
No encienda el hidrógeno con un encendedor o una cerilla. Si después de varios intentos no ha conseguido encender el hidrógeno, revise el montaje o pida ayuda a su instructor.
Coloca un vaso de precipitados seco y boca abajo (100 mL o 250 mL) sobre la llama de hidrógeno encendida. Se debe ver la condensación del agua en la superficie interior del vaso de precipitados.
Reacción del hidrógeno con un óxido de cobre
Calienta el tubo que contiene el óxido de cobre suavemente con el mechero Bunsen.
Después de unos minutos de calentamiento suave, aplique una llama fuerte y caliente una parte del óxido durante 5 minutos, luego pase la llama a otra parte del óxido durante otros 10 minutos, repitiendo hasta que todo el óxido haya tenido la oportunidad de reaccionar completamente con el hidrógeno.
El calentamiento del óxido puede hacer que la llama de hidrógeno se apague. No es necesario volver a encenderla.
Tras un total de 15 a 20 minutos de calentamiento, el óxido debe ser rojo, lo que indica que el material se ha se ha reducido a cobre metálico.
Apaga el mechero Bunsen y deja que el tubo de ensayo se enfríe al tacto mientras continúa el flujo de hidrógeno.
Mantenga el tubo de ensayo sujeto al soporte anular mientras separa el tapón y la unidad de tubos para que no el líquido vuelva a caer en el polvo sólido.
Utiliza una toalla de papel para limpiar toda el agua del tubo.
Mide la masa del tubo de ensayo en la balanza analítica.
No descarte el contenido del tubo de ensayo hasta que haya hecho los cálculos correspondientes
Desconecte la botella del generador y llénela de agua para detener la evolución del hidrógeno.
Vierta el líquido en el recipiente de desecho indicado. No dejar que el zinc metálico caiga en el recipiente, ya que puede reutilizarse.
Después del laboratorio
Cálculo de la fórmula empírica de un óxido de cobre
El óxido de cobre está compuesto por cobre y oxígeno. Calcular las masas de óxido de cobre, cobre y oxígeno a partir de las mediciones de masa en la hoja de datos. La masa del cobre se mide una vez finalizada la reacción. La masa del oxígeno es la diferencia entre la masa del CuO y la masa del cobre.
Utilice la masa atómica del cobre para determinar el número de moles de cobre presentes en el óxido de cobre de cobre:
Utilice la masa atómica del oxígeno para determinar el número de moles de oxígeno presentes en la muestra de óxido de cobre muestra de óxido de cobre.
La fórmula empírica es la proporción más pequeña de números enteros de átomos de cobre y oxígeno. Para obtener la fórmula empírica dividir el número de moles de cobre y de oxígeno por el menor de los dos números.
Después de dividir por el menor de los dos números, redondea cada uno al número entero más cercano.
Para más información Finding the formula of copper(II) oxide | Experiment
Como citar este artículo:
APA: (2022-08-24). Formula empírica del óxido de cobre. Recuperado de https://quimicafacil.net/manual-de-laboratorio/q-general-basica/formula-empirica-del-oxido-de-cobre/
ACS: . Formula empírica del óxido de cobre. https://quimicafacil.net/manual-de-laboratorio/q-general-basica/formula-empirica-del-oxido-de-cobre/. Fecha de consulta 2026-03-07.
IEEE: , "Formula empírica del óxido de cobre," https://quimicafacil.net/manual-de-laboratorio/q-general-basica/formula-empirica-del-oxido-de-cobre/, fecha de consulta 2026-03-07.
Vancouver: . Formula empírica del óxido de cobre. [Internet]. 2022-08-24 [citado 2026-03-07]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/q-general-basica/formula-empirica-del-oxido-de-cobre/.
MLA: . "Formula empírica del óxido de cobre." https://quimicafacil.net/manual-de-laboratorio/q-general-basica/formula-empirica-del-oxido-de-cobre/. 2022-08-24. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net