Tiempo de lectura estimado: 6 minutos
En química orgánica, la nitración es una clase general de procesos químicos para la introducción de un grupo nitro en un compuesto orgánico. El término también se aplica incorrectamente al proceso diferente de formación de ésteres de nitrato entre alcoholes y ácido nítrico (como ocurre en la síntesis de la nitroglicerina).
La diferencia entre las estructuras moleculares resultantes de los compuestos nitro y los nitratos es que el átomo de nitrógeno en los compuestos nitro está directamente unido a un átomo no oxigenado (normalmente carbono u otro átomo de nitrógeno), mientras que en los ésteres de nitrato (también llamados nitratos orgánicos), el nitrógeno está unido a un átomo de oxígeno que a su vez suele estar unido a un átomo de carbono (grupo nitrito).
Nitración aromática – Sustitución Aromática Electrofílica
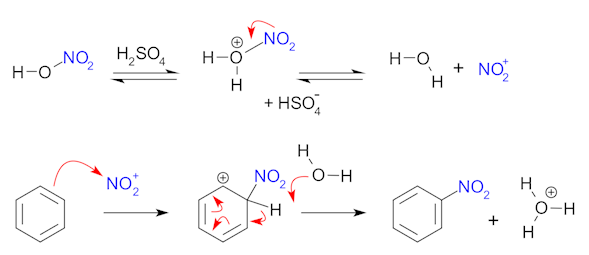
Las síntesis de nitración típicas aplican el llamado «ácido mixto», una mezcla de ácido nítrico concentrado y ácidos sulfúricos. Esta mezcla produce el ion nitronio (NO2+), que es la especie activa en la nitración aromática. Este ingrediente activo, que puede aislarse en el caso del tetrafluoroborato de nitronio, también efectúa la nitración sin necesidad del ácido mixto.
En las síntesis con ácido mixto, el ácido sulfúrico no se consume y, por tanto, actúa como catalizador y como absorbente del agua. En el caso de la nitración del benceno, la reacción se lleva a cabo a una temperatura cálida, que no supera los 50 °C. El proceso es un ejemplo de sustitución aromática electrofílica, que implica el ataque del anillo bencénico rico en electrones:
Materiales
- Erlenmeyer de boca ancha de 250 ml
- Matraz o balón de tres bocas de 250 ml
- Embudo de extracción
- Adaptador para termómetro (pozo para termómetro)
- Termómetro
- Frascos lavadores de gases (2)
- Adaptador con junta esmerilada y salida para tubo de goma
- Embudo de adición con compensación de presión
- Montaje para filtración al vacío (embudo Büchner, matraz Kitasato, bomba de vacío)
- Montaje de destilación al vacío
- Desecador
- Plancha de agitación magnética con calefacción
- Agitador magnético
- Rotavapor
- Baño frio de hielo/cloruro sódico
- Baño de aceite
Reactivos
- Tolueno destilado sobre sodio (9.21 g, 10.6 mL, 100 mmol)
- Acido sulfúrico concentrado (12.5 mL – 228 mmol)
- Acido nítrico concentrado (10.6 mL – 153 mmol)
- Solución de hidróxido de sodio 2N (100 mL)
- Ciclohexano (60 mL)
- Bicarbonato de sodio (1 g en 10 mL)
- Sulfato de sodio anhidro
- Etanol
- Metanol
Procedimiento
Tiempo necesario: 5 horas
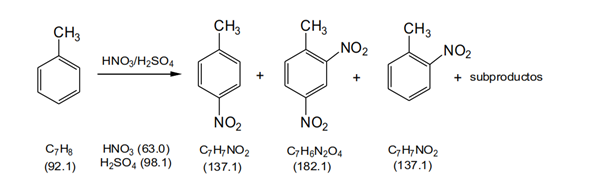
Nitración de tolueno
- Preparación del ácido nitrante
Se añaden lentamente con agitación constante y enfriando con hielo 12,5 mL (228 mmol) de H2SO4 concentrado a 10,6 mL (153 mmol) de HNO3 concentrado y enfriado en hielo, contenido en un matraz Erlenmeyer de boca ancha de 250 mL. Enfriar seguidamente el ácido nitrante hasta -5 °C, empleando un baño de hielo-sal.
Anuncio - Montaje de reacción
El montaje de la reacción consta de un matraz o balón de tres bocas de 250 mL con una barra magnética para agitación, un pozo para termómetro y un embudo de adición con presión compensada. La boca restante del matraz se conecta a un adaptador esmerilado con salida para un tubo de goma como medio de salida de los posibles gases nitrosos. El tubo de goma se conecta a un frasco lavador de gases, que se conecta a su vez a otro que contiene 100 mL de disolución acuosa de NaOH.

Introducir en el matraz de reacción 9,21 g (10,6 mL, 100 mmol) de tolueno, recién destilado sobre sodio. Enfriar a -10 °C el tolueno en el matraz de reacción con una mezcla refrigerante hielo-sal. El ácido nitrante frio se añade al embudo de adición en pequeñas porciones (para evitar que se caliente) al montaje de la reacción y se adiciona lentamente gota a gota con enfriamiento para mantener la temperatura interior de la mezcla de reacción por debajo de 5 °C.
Se tarda aproximadamente. 1,5 horas en adicionar todo el ácido nitrante. Una vez terminada la adición, y manteniendo la mezcla de reacción en el baño de hielo, se deja que alcance lentamente la temperatura ambiente. El proceso de alcanzar la temperatura ambiente debe hacerse de forma muy lenta para evitar la formación de gases nitrosos. Una vez alcanzada la temperatura ambiente se mantiene la agitación de la mezcla de reacción durante otras dos horas.
- Purificación
Pasar la mezcla de reacción a un vaso de precipitados de 250 mL conteniendo 50 g de hielo. Pasar entonces la mezcla a un embudo de extracción, y extraer una vez con 40 mL de ciclohexano y dos veces más con 10 mL cada una.
Anuncio Las fases orgánicas combinadas se lavan a continuación con 10 mL de agua, 10 mL de disolución acuosa saturada de NaHCO3 y de nuevo con 10 mL de agua.
La fase orgánica se seca sobre Na2SO4 anhidro (cubrir el fondo del matraz Erlenmeyer en el que se encuentra), el desecante se elimina por filtración y el disolvente se elimina empleando el rotavapor. El producto de reacción se obtiene como un residuo aceitoso. Rendimiento de producto esperado: 10,1 g.
Purificar el producto crudo por destilación a 20 hPa (0.02 bar). El frasco receptor debe enfriarse. El producto deseado destila en un intervalo de 100–130 °C (20 hPa) proporcionando 8,50 g del producto amarillo como un líquido y un residuo de la destilación de 1,30 g.
- Separación de productos
El producto líquido de la destilación cristaliza a -20 °C. El material cristalino se aísla por filtración en un embudo Büchner enfriado y se recristaliza de unos pocos mL de metanol. Si es necesario, repetir la recristalización. Rendimiento: 1,80 g (13,1 mmol, 13%) de 4-nitrotolueno; pf 49 °C
Anuncio Recristalizar el residuo sólido de la destilación con unos pocos mL de etanol. Recoger el producto cristalino por filtración con un embudo Büchner y secarlo en un desecador sobre gel de sílice. Rendimiento: 500 mg (2,75 mmol, 3%) de 2,4-dinitrotolueno; pf 69 °C
Notas
El rendimiento de 2-nitrotolueno no puede especificarse, debido a la separación incompleta de los productos.
No se recomienda reducir el escalado de la reacción. Resulta difícil separar el producto bruto en los isómeros puros.
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Nivel de dificultad: Alto
Para más información Nitration of Toluene (Electrophilic Aromatic Substitution)
Como citar este artículo:
APA: (2022-02-09). Nitración aromática. Recuperado de https://quimicafacil.net/manual-de-laboratorio/nitracion-aromatica/
ACS: . Nitración aromática. https://quimicafacil.net/manual-de-laboratorio/nitracion-aromatica/. Fecha de consulta 2026-02-20.
IEEE: , "Nitración aromática," https://quimicafacil.net/manual-de-laboratorio/nitracion-aromatica/, fecha de consulta 2026-02-20.
Vancouver: . Nitración aromática. [Internet]. 2022-02-09 [citado 2026-02-20]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/nitracion-aromatica/.
MLA: . "Nitración aromática." https://quimicafacil.net/manual-de-laboratorio/nitracion-aromatica/. 2022-02-09. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net