Tiempo de lectura estimado: 7 minutos
Luigi Galvani fue el primero en describir el fenómeno eléctrico asociado a dos metales en contacto al experimentar en un anca de rana, las celdas galvánicas fueron nombradas en su honor.
La electrolisis de algunas soluciones acuosas de sales puede llevar a la oxidación o la reducción de los iones de la sal siempre que estos sean más fácilmente oxidados o reducidos que el agua misma. También se sabe que la oxidación de un ion metálico (agente reductor) es la perdida de electrones que es promovida por otro ion metálico (agente oxidante) que gana los electrones.
Fundamento teórico de las celdas galvánicas
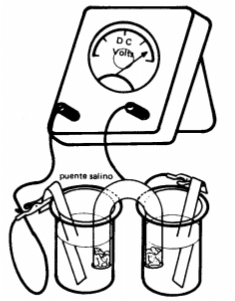
La semirreacción de oxidación tiene lugar en el electrodo (ánodo) de una semipila y la semirreacción de reducción tiene el lugar en el electrodo (cátodo) de la otra semipila. Cuando las dos semipila (los dos vasos que se observan en la figura) se unen a través de un puente salino (tubo en U) de tal forma que sus disoluciones estén en contacto, se produce una pila, cuyo voltaje es una medida de la tendencia a la acción reactiva de la pila.
Las dos semipilas o semiceldas deben estar constituidas por dos vasos cuyas disoluciones estén conectadas entre sí por un puente salino (un tubo en U grande que contiene una solución saturada de un electrodo tal como NaCl), como se muestra en la figura.
Cuando metales distintos están separados por un electrolito o una capa delgada de un gas, se establece entre ellos una diferencia de potencial. Los diferentes metales pueden ordenarse en una serie, en la cual cada uno de ellos sea más electropositivo que el siguiente, este orden recibe el nombre de serie electromotriz.
La serie electromotriz es capaz de explicar cuantitativamente, la tendencia y el porqué de una oxidación o reducción de un metal determinado en presencia de otro o de un ambiente en específico. Empleando un medio donde se permita el flujo de electrones, es posible determinar la serie electromotriz con la ayuda de láminas o alambres de varios metales.
Materiales
- 2 electrodos de grafito
- Amperímetro o multímetro con cables y pinzas
- Conector para batería de 8V
- Tubo en forma de U
- 3 vasos de precipitados de 150 mL
- Tubos de ensayo
- Dos goteros o pipetas Pasteur con goma
- Laminas o alambre de los siguientes metales; cobre, zinc, plomo, hierro, aluminio y magnesio
- Soporte universal y pinzas
- Una papaya pequeña
Reactivos
100 ml de solución de cada uno de los siguientes compuestos:
- Nitrato de zinc 0.5 M
- Nitrato de cobre 0.5 M
- Nitrato de plomo 0.5 M
- Yoduro de potasio 0.1 M
- Sln saturada de cloruro de sodio
- Indicador de Fenolftaleína
- Tetracloruro de carbono
Procedimiento
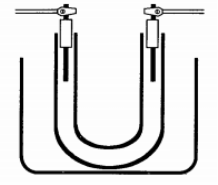
Electrolisis de yoduro de potasio
Realizar el montaje mostrado en la figura a continuación con ayuda del soporte universal y pinzas
Colocar suficiente solución de yoduro de potasio de tal manera que el tubo quede lleno, dejando un espacio de 0.5 cm aproximadamente libre.
Colocar los electrodos de grafito y electrolizar con ayuda de la pila de 8 V.
Pasados 10 minutos, desconectar y retirar los electrodos. Retirar el liquido café que se encuentra en el lado del ánodo empleando un gotero o pipeta Pasteur y transferir a un tubo de ensayo. Agregar 1 mL de tetracloruro de carbono y agitar.
Empleando otro gotero o pipeta Pasteur, tomar 2 mL aproximadamente del liquido que se encuentra en el lado correspondiente al cátodo y transferir a un tubo de ensayo. Agregar 3 gotas de fenolftaleína.
Construcción de celdas galvánicas
- Celda zinc – cobre
En un vaso de precipitados de 150 mL coloque solución de nitrato de cobre 0.5 M hasta la mitad de la altura. Coloque una placa o alambre de cobre en la solución y conectar al terminal positivo del voltímetro o multímetro.
En otro vaso de precipitados de 150 mL, agregar solución de nitrato de zinc 0.5 M hasta la mitad del volumen y colocar una placa o alambre de zinc. Conectar el metal al terminal negativo del voltímetro o multímetro.
Anotar la lectura del voltaje con el montaje realizado hasta el momento. Posteriormente, unir ambos vasos a través de un tubo en U invertido, el cual se encuentra lleno de solución saturada de cloruro de sodio y los extremos taponados con algodón empapado en la solución. El tubo en U actuará como puente salino. Anotar el valor de voltaje reportado por el equipo.
- Celda plomo – cobre
Desmonte cuidadosamente el anterior montaje cuidando de no contaminar el vaso de precipitados con el electrodo de cobre y solución de nitrato de cobre.
En un vaso de precipitados de 150 mL limpio y seco, colocar solución de nitrato de plomo 0.5 M hasta la mitad del volumen y un trozo o alambre de plomo. Conectar al terminal negativo del voltímetro o multímetro.
Anotar el voltaje reportado por el equipo, colocar el puente salino como en la anterior experiencia y anotar el nuevo voltaje reportado.
Determinación de la serie electromotriz
Tomar las laminas o alambres disponibles de los metales cobre, zinc, plomo, hierro, aluminio y magnesio y limpiar la grasa con acetona y lijar ligeramente la superficie para retirar cualquier capa de oxido formada.
Tomar la papaya y medir una distancia aproximada de 10 cm. En un extremo de la medida insertar la lamina de cobre y al otro extremo una lamina de un metal distinto. Conectar los metales al voltámetro o multímetro y medir la diferencia de potencial de los metales. Anotar el valor.
Dejando el electrodo de cobre como fijo, cambiar el otro electrodo por un metal distinto, medir el diferencial de voltaje y anotar su valor.
Después del experimento
Escribir las reacciones que ocurrieron en cada una de las celdas galvánicas preparadas, así como identificar las semirreacciones en cada caso.
En el ensayo de electrolisis de yoduro de potasio, identificar en que extremo se obtuvo yodo metálico y en cual se obtuvieron iones de potasio, ¿qué fenómeno químico se empleo para determinar la presencia de estos elementos?
De las soluciones y metales trabajados, identificar cuales pares de celdas generan mayor diferencial de voltaje, explique con base a las propiedades físicas y químicas de los elementos el porque de las diferencias en los voltajes obtenidos.
Empleando como electrodo de referencia el cobre, armar una serie electromotriz con los metales empleados en la práctica. A nivel técnico, ¿Cuál es el electrodo de referencia de las series electromotrices que se encuentran en la literatura?
Recomendaciones de seguridad
Se recomienda tener cuidado al momento de medir el potencial de las celdas galvánicas para evitar daño en el equipo de medición o la descarga de potencial a través del cuerpo. No tocar con las manos desnudas los electrodos en especial si se encuentran en un montaje.
Se debe leer el manual de operación del amperímetro o multímetro a emplear, o recibir instrucción sobre su correcto manejo por parte de personal experto.
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información Galvanic Cells
Como citar este artículo:
APA: (2019-09-04). Construcción de celdas galvánicas o voltaicas. Recuperado de https://quimicafacil.net/manual-de-laboratorio/celdas-galvanicas/
ACS: . Construcción de celdas galvánicas o voltaicas. https://quimicafacil.net/manual-de-laboratorio/celdas-galvanicas/. Fecha de consulta 2026-02-14.
IEEE: , "Construcción de celdas galvánicas o voltaicas," https://quimicafacil.net/manual-de-laboratorio/celdas-galvanicas/, fecha de consulta 2026-02-14.
Vancouver: . Construcción de celdas galvánicas o voltaicas. [Internet]. 2019-09-04 [citado 2026-02-14]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/celdas-galvanicas/.
MLA: . "Construcción de celdas galvánicas o voltaicas." https://quimicafacil.net/manual-de-laboratorio/celdas-galvanicas/. 2019-09-04. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net