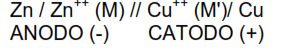Tiempo de lectura estimado: 10 minutos
Las celdas electrolíticas tienen dos características importantes, una la fuerza electromotriz de la celda, y la otra es la reacción que sucede para generar la fuerza electromotriz.
Pila de Daniel
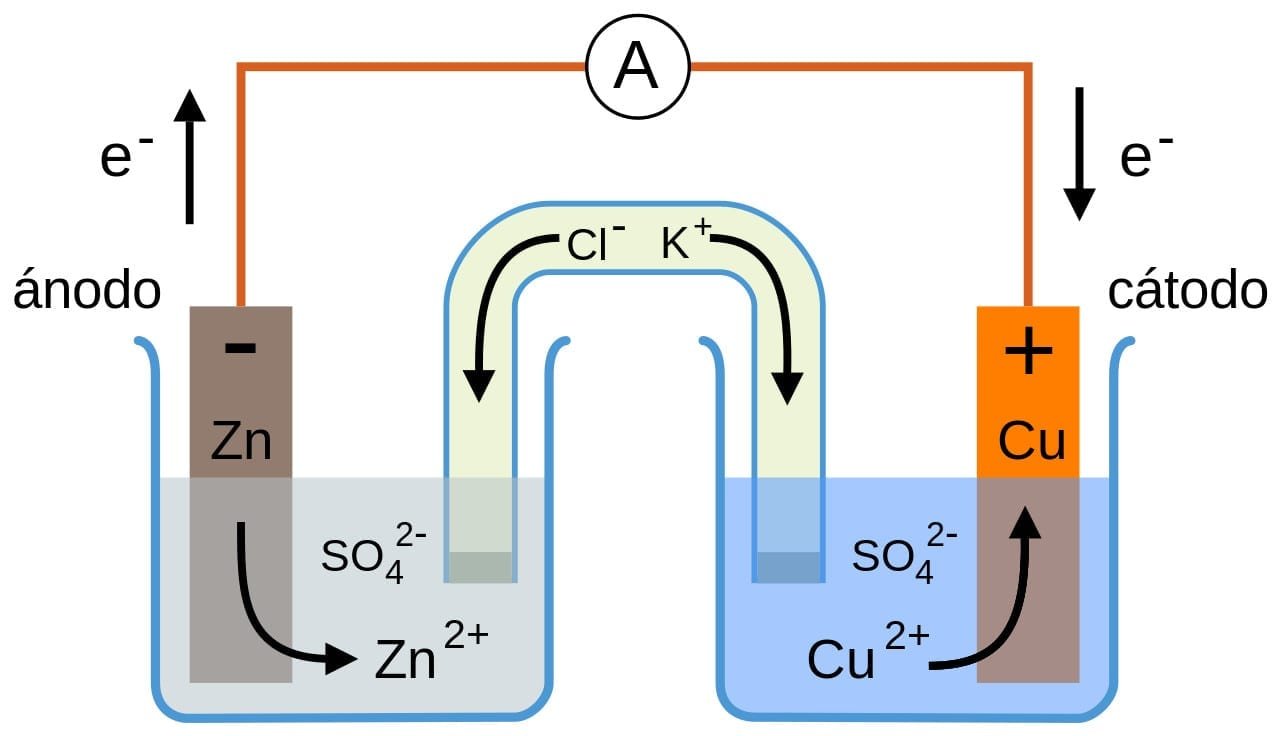
Consideremos una pila de Daniell, ésta consta de un electrodo de zinc sumergido en una disolución de sulfato de zinc y otro de cobre sumergido en una disolución de sulfato de cobre (II).
A cada electrodo con su solución se le llama semicelda; en este caso, las dos semiceldas pueden estar separadas bien por un puente salino, o bien por un tabique poroso. El uso de un puente o barrera evita que se mezclen las dos disoluciones, pero permitiendo el contacto eléctrico.
Cuando los dos electrodos se unen, una corriente eléctrica circula de uno al otro, esta corriente eléctrica puede ser cuantificada al conectar un amperímetro en serie.
Este fenómeno ocurre debido a que existe una diferencia de potencial entre los dos electrodos. La reacción global que da lugar a esta fuerza electromotriz es:
dicha reacción se puede descomponer en dos semirreacciones, una que tiene lugar en el electrodo de la izquierda,
y otra que tiene lugar en el electrodo de la derecha,
Toda reacción que da lugar a una liberación de electrones es una oxidación y aquella que consume electrones es una reducción; por tanto, en el electrodo de la izquierda ocurre una oxidación, quedando el Zn cargado negativamente, y en la semicelda del Cu ocurre una reducción, quedando este cargado positivamente. Los electrones salen del electrodo negativo y van al positivo a través del conductor que une ambos electrodos.
El electrodo en el que ocurre la oxidación se llama ánodo y está cargado negativamente. Por su parte, el electrodo en el que ocurre la reducción se llama cátodo y está cargado positivamente. En la solución los electrones son transportados por los iones, moviéndose los iones negativos hacia el electrodo negativo y los positivos hacia el electrodo positivo. Si se suman las dos semirreacciones se obtiene la reacción global, que es la reacción de la celda. Igualmente, la fuerza electromotriz de una celda galvánica se define como:
donde ECATODO y EANODO son los potenciales en los terminales de los electrodos de la derecha e izquierda, ambos medidos con el mismo patrón. La celda se suele representar por,
donde M y M’ son las concentraciones molares de las disoluciones de Zn2+ y Cu2+, cada línea perpendicular representa una interfase, y la doble línea perpendicular representa que la unión entre las dos semiceldas no contribuye a la fuerza electromotriz de la celda.
Celdas electrolíticas
La fuerza electromotriz de las pilas o celdas electrolíticas depende tanto de la naturaleza de los sistemas redox que la constituyen, como de la temperatura y de la concentración de las especies que intervienen en los procesos de electrodo. La Termodinámica proporciona las relaciones que ligan las diferentes variables, indicándonos qué reacciones ocurrirán espontáneamente y cuáles no. La relación que existe entre trabajo eléctrico (W) y energía de Gibbs (DG) es,
Como el trabajo eléctrico coincide con el trabajo necesario para trasladar un cierto número de electrones de un electrodo a otro, al trasladar n moles de electrones, trasladamos n*F culombios de carga y por ello el trabajo eléctrico será:
Donde F es el valor de la constante de Faraday (F= 96485,3365 C mol-1), combinando ambas expresiones queda
siendo n los moles de electrones intercambiados en el proceso redox de la pila. Entonces, la espontaneidad de la reacción redox implicada en una pila se puede juzgar por el signo de ∆G ó E; un cambio en la energía libre de Gibbs negativo (o un cambio positivo en la fuerza electromotriz de la celda) indicará que la reacción es espontanea. Un cambio positivo en la energía libre de Gibbs (o un cambio negativo en la fuerza electromotriz de la celda) indicara que la reacción no es espontanea y su el valor de la energía libre de Gibbs es = 0, señalara que el sistema se encuentra en equilibrio.
Si deseamos tener en cuenta el efecto de la temperatura en la espontaneidad de la reacción podemos emplear la ecuación de Nernst;
Donde:
E = fuerza electromotriz
E° = fuerza electromotriz estándar (medida en condiciones estándar)
T = temperatura en escala absoluta
F = constante de Faraday
n = numero de moles de electrones implicados en el proceso
Q = cociente de las concentraciones de las soluciones en cada semicelda
R = constante universal de los gases
Materiales
- Electrodo de cobre
- Electrodo de zinc
- 2 Electrodos de grafito
- 4 erlenmeyer de 100 mL de boca esmerilada con tapón
- 5 vasos de precipitados de 100 mL
- 1 pipeta graduada de 10 mL
- 4 pinzas metálicas de cocodrilo
- Papel de filtro en tiras
- Soporte universal
- 2 pinzas para bureta con nuez
- Erlenmeyer de 500 mL
- 1 bureta de 50 mL
- Trozo largo de cable eléctrico (preferiblemente de cobre)
- Balanza analítica
- Plancha de agitación
- Amperímetro o multímetro
Reactivos
100 ml de solución de cada uno de los siguientes compuestos:
- Sulfato de cobre
- Sulfato de zinc
- Yodo
- Yoduro de potasio
- Sulfato de hierro (II)
- Nitrato de hierro (III)
- Cloruro de sodio
Procedimiento – Celdas electrolíticas y su potencial
Preparación de semiceldas electrolíticas
Semicelda de Cu: Una barra u hoja de Cu limpio (previamente lijado) se introduce en unos 20 mL de solución de sulfato de cobre 0.1 M contenido en un vaso de precipitado de 100mL. Preparar dos semiceldas de cobre.
Semicelda de Zn: Una barra u hoja de zinc limpio (previamente lijado) se introduce en unos 20 mL de solución de sulfato de cobre 0.1M contenido en un vaso de precipitado de 100ml.
Semicelda de yodo: En un vaso de precipitado de 100 mL se coloca una mezcla de 10 mL, medidos con pipeta, de solución de yodo 0.1 M y 10 mL de solución de yoduro de potasio 0.1 M. También se introduce un electrodo limpio de grafito.
Semicelda de hierro: En un vaso de precipitado de 100 mL se coloca una mezcla de 10 mL, medidos con pipeta, de solución de nitrato de hierro (III) 0.1M y 10 mL de solución de sulfato de hierro 0.1M. También se introduce un electrodo limpio de grafito.
Montaje de celdas electrolíticas
Cada una de las celdas electrolíticas, o pilas, se prepara uniendo un par de semiceldas por un puente salino. El puente salino se prepara humedeciendo una tira de papel de filtro en una solución saturada de cloruro de sodio, e introduciendo cada extremo de la tira en una de las semiceldas. Una vez hecho esto, se medirá la diferencia de potencial entre los dos electrodos conectando el amperímetro o multímetro a los electrodos o con la ayuda de cables eléctricos.
Montar cada una de las siguientes combinaciones de semiceldas y medir el diferencial de potencial.
- Semicelda de zinc / semicelda de cobre
- Semicelda de yodo / semicelda de cobre
- Semicelda de zinc / semicelda de yodo
- Semicelda yodo / semicelda de hierro
- Semicelda de hierro / semicelda de cobre
Construir un sistema consistente en la semicelda de zinc, unida a través de un puente salino a una semicelda de cobre, unir esta semicelda con la otra semicelda de cobre colocando un trozo de cable conductor entre los dos electrodos de cobre (ayudarse de las pinzas cocodrilo para mantener en contacto entre el cable y el metal) y la ultima celda de cobre unida a través de un puente salino a la semicelda de yodo. Medir la diferencia de potencial entre el electrodo de zinc y el electrodo de grafito de la última celda.
Repetir el anterior procedimiento reemplazando la semicelda de yodo por la semicelda de hierro y medir el potencial.
Después del experimento
Escribir las reacciones que ocurrieron en cada una de las celdas electrolíticas preparadas, así como identificar las semirreacciones en cada caso.
Estimar el potencial de celda de cada una de las celdas electrolíticas ensayadas empleando los datos obtenidos en el ensayo.
¿Qué significa un valor negativo de corriente eléctrica al momento de medir el potencial en una celda determinada?
¿Se puede observar algún cambio físico sobre la superficie de los electrodos metálicos empleados en la experiencia?
Recomendaciones de seguridad
Se recomienda tener cuidado al momento de medir el potencial de las celdas electroquímicas para evitar daño en el equipo de medición o la descarga de potencial a través del cuerpo. No tocar con las manos desnudas los electrodos en especial si se encuentran en un montaje.
Se debe leer el manual de operación del amperímetro o multímetro a emplear, o recibir instrucción sobre su correcto manejo por parte de personal experto.
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información Voltaic Cells
Como citar este artículo:
APA: (2019-08-07). Elaboración de celdas electrolíticas y medición de su potencial. Recuperado de https://quimicafacil.net/manual-de-laboratorio/celdas-electroliticas/
ACS: . Elaboración de celdas electrolíticas y medición de su potencial. https://quimicafacil.net/manual-de-laboratorio/celdas-electroliticas/. Fecha de consulta 2025-12-31.
IEEE: , "Elaboración de celdas electrolíticas y medición de su potencial," https://quimicafacil.net/manual-de-laboratorio/celdas-electroliticas/, fecha de consulta 2025-12-31.
Vancouver: . Elaboración de celdas electrolíticas y medición de su potencial. [Internet]. 2019-08-07 [citado 2025-12-31]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/celdas-electroliticas/.
MLA: . "Elaboración de celdas electrolíticas y medición de su potencial." https://quimicafacil.net/manual-de-laboratorio/celdas-electroliticas/. 2019-08-07. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net