Tiempo de lectura estimado: 6 minutos
Un eudiómetro es un dispositivo de laboratorio que mide el cambio en el volumen de una mezcla de gases después de un cambio físico o químico.
Que es un eudiómetro
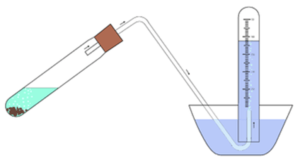
Según la reacción que se esté midiendo, el dispositivo puede adoptar diversas formas. En general, es similar a un cilindro graduado y se encuentra más comúnmente en dos tamaños: 50 mL y 100 mL. Está cerrado en el extremo superior, con el extremo inferior sumergido en agua o mercurio. El líquido atrapa una muestra de gas en el cilindro, y la graduación permite medir el volumen del gas.
Para algunas reacciones, se colocan dos alambres de platino (elegidos por su no reactividad) en el extremo sellado para que se pueda crear una chispa eléctrica entre ellos. La chispa eléctrica puede iniciar una reacción en la mezcla de gases y la graduación en el cilindro se puede leer para determinar el cambio en volumen resultante de la reacción. El uso del dispositivo es bastante similar al del barómetro original, excepto que el gas en su interior desplaza parte del líquido utilizado.
Etimología
El nombre «eudiómetro» proviene del griego εὔδιος eúdios, que significa claro o suave, y es la combinación del prefijo eu- que significa «bueno», y -dios que significa «celestial» o «de Zeus» (el dios del cielo y la atmósfera), con el sufijo -metro que significa «medida».
Dado que el eudiómetro se utilizaba originalmente para medir la cantidad de oxígeno en el aire, que se pensaba que era mayor en el clima «agradable», la raíz eudio- describe adecuadamente el aparato.
Historia
En 1772, Joseph Priestley comenzó a experimentar con diferentes «aires» utilizando su propio diseño de balón neumático, en el cual el mercurio, en lugar de agua, atraparía gases que normalmente eran solubles en agua.
A través de estos experimentos, Priestley se le atribuye el descubrimiento de muchos gases nuevos, como el oxígeno, el cloruro de hidrógeno y el amoníaco.
También descubrió una forma de medir la pureza o «bondad» del aire mediante la «prueba de aire nitroso». El eudiómetro funciona sobre la mayor solubilidad de NO2 en agua en comparación con NO, y la reacción de oxidación de NO a NO2 por el oxígeno del aire:
2NO + O2 → 2NO2
Se combina una cantidad de aire con NO sobre agua, y el compuesto más soluble, NO2, se disuelve, dejando el resto del aire ligeramente contraído en volumen. Cuanto más rico en oxígeno estuviera el aire, mayor sería la contracción.
Marsilio Landriani estaba estudiando química neumática con Pietro Moscati cuando intentaron cuantificar la prueba de ácido nítrico de Priestley para la calidad del aire. Landriani utilizó un balón neumático en forma de un cilindro graduado alto sobre agua. Al medir la salubridad del aire, lo llamó eudiómetro. Un asociado de Moscati, Felice Fontana, también diseñó un eudiómetro sobre los mismos principios y cuantificó la salubridad del aire.
El eudiómetro con la prueba de aire nitroso fue la manera en que Jan Ingenhousz verificó que las burbujas liberadas bajo el agua por las hojas de las plantas expuestas a la luz solar eran burbujas de oxígeno. Su descripción de la fotosíntesis se publicó en 1779, y en 1785 escribió sobre eudiómetros en el Journal de Physique (v 26, p 339). Según un biógrafo, Ingenhousz indicó que «muchos instrumentos eran llamados eudiómetros, aunque estrictamente hablando no merecían el nombre … podían existir malentendidos cuando no todos estaban usando los mismos instrumentos».
La pistola de Volta
Una versión electrificada del eudiómetro fue desarrollada por el Conde Alessandro Volta (1745-1827), un físico italiano conocido por sus contribuciones a la batería eléctrica y la electricidad. Además de su función en el laboratorio, el eudiómetro también es conocido por su participación en la «pistola Volta». Volta inventó este instrumento en 1777 con el propósito de probar la «bondad» del aire, analizar la inflamabilidad de los gases o demostrar los efectos químicos de la electricidad.
La pistola de Volta tenía un tubo de vidrio largo cerrado en la parte superior, similar a un eudiómetro. Dos electrodos se introducían en el tubo y generaban una brecha de chispa en su interior. El uso inicial de Volta de este instrumento se centró en el estudio de gases de pantano en particular. La pistola de Volta se llenaba con oxígeno y otro gas.
La mezcla homogénea se sellaba con corcho. Una chispa podía introducirse en la cámara de gas mediante electrodos, y posiblemente catalizar una reacción por electricidad estática, utilizando el electroforo de Volta. Si los gases eran inflamables, explotarían y aumentarían la presión dentro de la cámara de gas.
Esta presión sería demasiado grande y finalmente haría que el corcho saliera disparado. La pistola de Volta se fabricaba con vidrio o latón, sin embargo, debido a la electricidad, el vidrio era vulnerable a explotar. Los extensos estudios de Volta sobre la medición y creación de corrientes eléctricas de alto nivel llevaron a que la unidad eléctrica, el voltio, fuera nombrada en su honor.
En 1785, Henry Cavendish utilizó un eudiómetro para determinar la fracción de oxígeno en la atmósfera terrestre.
Aplicaciones del eudiómetro
Las aplicaciones de un eudiómetro incluyen el análisis de gases y la determinación de las diferencias de volumen en reacciones químicas. El eudiómetro se llena de agua, se invierte de manera que su extremo abierto esté hacia abajo (mientras se sujeta el extremo abierto para evitar que el agua escape) y luego se sumerge en una cubeta de agua.
Eudiómetro en reacciones químicas
Si se está llevando a cabo una reacción química a través de la cual se crea gas. Uno de los reactivos suele estar en la parte inferior del eudiómetro (que fluye hacia abajo cuando se invierte el eudiómetro) y el otro reactivo está suspendido en el borde del eudiómetro, generalmente mediante un alambre de platino o cobre (debido a su baja reactividad).
Cuando el gas creado por la reacción química se libera, debería ascender al eudiómetro para que el experimentador pueda leer con precisión el volumen del gas producido en cualquier momento dado.
Normalmente, una persona leería el volumen cuando la reacción está completada. Este procedimiento se sigue en muchos experimentos, incluido un experimento en el que se determina experimentalmente la constante R de la ley de los gases ideales.
El eudiómetro tiene una estructura similar al barómetro meteorológico. De manera similar, un eudiómetro utiliza agua para liberar gas en el tubo del eudiómetro, convirtiendo el gas en una cantidad visible y medible. Una medición precisa de la presión al realizar estos experimentos es crucial para los cálculos involucrados en la ecuación PV=nRT, ya que la presión podría cambiar la densidad del gas.
Para más información Landriani’s eudiometer
Como citar este artículo:
APA: (2024-03-25). Eudiómetro. Recuperado de https://quimicafacil.net/infografias/material-de-laboratorio/eudiometro/
ACS: . Eudiómetro. https://quimicafacil.net/infografias/material-de-laboratorio/eudiometro/. Fecha de consulta 2024-07-27.
IEEE: , "Eudiómetro," https://quimicafacil.net/infografias/material-de-laboratorio/eudiometro/, fecha de consulta 2024-07-27.
Vancouver: . Eudiómetro. [Internet]. 2024-03-25 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/infografias/material-de-laboratorio/eudiometro/.
MLA: . "Eudiómetro." https://quimicafacil.net/infografias/material-de-laboratorio/eudiometro/. 2024-03-25. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net