Por Alfredo Negro Albañil
Tiempo de lectura estimado: 14 minutos

El agua tiene unas propiedades que parece que se han hecho a la medida de nuestro sistema de vida, o es nuestro sistema de vida el que se adapta a las propiedades del agua. El cuerpo humano, contiene entre un 65 y un 75 % de agua en peso, el porcentaje de agua en los alimentos varía desde el 97% en la lechuga y el 15% en alimentos secos como la harina. Todos los seres vivos desde el nivel celular al más complejo, existen en un medio acuoso y su porcentaje de agua es muy variable, pero importante en todos los casos. El agua recubre el 71 % de la superficie de la corteza terrestre, la cantidad de agua en la naturaleza se mantiene constante gracias al ciclo del agua, que es un continuo intercambio del agua entre la atmósfera, el agua superficial, subterránea y los seres vivos.
Las propiedades físicas y químicas del agua, “los secretos del agua”, son muy distintas a compuestos similares y se deben a su estructura.

La molécula de agua, está compuesta por un átomo de oxígeno y dos de hidrógeno, debido a la mayor electronegatividad del oxígeno hay mayor densidad electrónica en su zona y se crea una carga parcial negativa (δ=), por el contrario, en las proximidades de cada hidrógeno se genera una carga parcial positiva (δ+). Teniendo en cuenta estos momentos dipolares parciales y el ángulo de 104,5º que forman el oxígeno y los dos hidrógenos, da lugar a un momento dipolar neto para la molécula de agua de 1,84 D (Debye), este valor es de los más elevados de todos los líquidos: ciclohexano 0,00 D, amoniaco y cloroformo 1,50 D.
Las cargas eléctricas parciales del oxígeno y de los hidrógenos, crean uniones entre las distintas moléculas de agua, denominados “puentes de hidrógeno”, que son el origen de muchas de las propiedades físicas y químicas del agua.
Formación de puentes de hidrógeno.
Propiedades físicas del agua, “los secretos del agua”:
Tres estados de la materia
El agua dependiendo de la presión y temperatura, se encuentra en la naturaleza en los tres posibles estados de la materia.
Es líquida en el rango de temperaturas y presiones más adecuado para las formas de vida conocidas: a la presión de 1 atm y entre 0 °C y 100 °C, de temperatura.
A presión de 1 atm, el agua pasa de líquido a vapor, punto o temperatura de ebullición, a 100 ºC, esta temperatura varía con la presión exterior. En la cima del Monte Everest, donde la presión atmosférica es de alrededor de 0,34 atm, el agua hierve a unos 70 °C.
La temperatura de paso de líquido a sólido o punto de congelación, a 1 atm es de 0°C.
El agua, también puede pasar de sólido a gas directamente, a este proceso se le llama sublimación.
Características sensoriales
Incolora. El agua no tiene color y es trasparente, sin embargo, en grandes masas se aprecia un color azulado-verdoso. Esto se debe a que el agua absorbe las longitudes de onda más altas de la luz blanca del sol y la luz reflejada corresponde a los tonos azulados.
Insípida y no tiene olor. En la naturaleza, existen muy pocos compuestos insípidos y sin olor, esta es otra de las diferencias del agua con la mayoría de los compuestos.
El agua, disolvente universal

El agua es el mejor disolvente para compuestos iónicos o polares que existe en la naturaleza, la solubilidad aumenta al aumentar la temperatura. La solubilidad del cloruro sódico (sal común) a 20 ºC es de 350 g/l, para otros compuestos iónicos como el nitrato de plata (AgNO3) la solubilidad a 20ºC es de 2.220 g/l (no es un error, estas leyendo bien). Esta propiedad hace que sea posible la vida tal como la conocemos, la alta concentración de sales en los mares, la fácil trasmisión de los compuestos iónicos a través de los fluidos biológicos, constituidos mayoritariamente por este liquido: orina, sangre, suero. La distribución de los elementos necesarios para el crecimiento de los vegetales, etc.
Esta propiedad se debe a la polarización de la molécula de agua,que permite que se establezcan múltiples uniones electrostáticas entre el oxígeno (δ=) y los iones positivos y de los hidrógenos (δ+) con los iones negativos, de los compuestos iónicos, estas fuerzas hacen que se “desmorone” rápidamente la estructura cristalina al entrar en contacto con el, es decir que se disuelvan.
Dilatación anómala del agua

El agua al congelarse a 0ºC, pasa de estado líquido a estado sólido y aumenta considerablemente su volumen, por eso los hielos de nuestras bebidas y refrescos flotan. La importancia de que el hielo flote sobre la superficie de las aguas es enorme, ya debido a esta propiedad extraordinaria y distinta a otros líquidos, es posible que exista vida en las masas acuosas de las zonas frías, pues permite que la flora y la fauna sigan en contacto con el líquido y no con una masa de hielo, que les aprisionaría y haría imposible la vida. Además, el hielo formado constituye una capa aislante, que impide que la temperatura baje de 0ºC y continúe el proceso de congelación de las capas inferiores.

Este comportamiento se debe a que, en las moléculas de agua líquida a 0°C, los puentes de hidrógeno y a los ángulos de su estructura (104.5°), se encuentran colocados a una distancia determinada, por lo que ocupan un volumen concreto. Al pasar al estado sólido, estas fuerzas de interacción se “reconfiguran” para establecer una red cristalina en el sistema hexagonal, con ángulos, mayores, de 109°, estableciéndose distancias más grandes entre las moléculas, por lo que el volumen de la misma masa de agua es mayor y por tanto menor su densidad (d=masa/volumen), debido a esto el hielo flota sobre el agua líquida. La densidad del agua líquida a 0° es 1,00 g/ml, se toma como referencia, al congelarse desciende bruscamente hacia 0,9168 g/ml, debido a que en la congelación su volumen aumenta en un 9 por 100.
Calor latente de vaporización
El calor latente de vaporización es la cantidad de calor necesario para que un gramo de agua pase de líquido a vapor. Para el agua este valor es 539,40 cal/g, amoniaco: 328,37 cal/g, benceno: 94,98 cal/g, estos valores tan elevados del agua respecto a otros disolventes, se deben a las altas fuerzas de atracción que se establecen entre las moléculas de agua debido a los puentes de hidrógeno. El paso de líquido a vapor, implica la separación de las moléculas y para vencer las fuerzas de atracción que existen entre ellas, hay que aportar energía calorífica.
Esta propiedad es la responsable de la regulación térmica del cuerpo, mediante la sudoración. Para evaporarse el agua, (sudor) es necesario absorber el calor latente de vaporización, se retira calor del cuerpo, por lo que este se enfría.
También, debido a esta propiedad, se utiliza este liquido, tanto en estado líquido como en estado vapor, como transmisores de calor en diversos sistemas de intercambio calórico.
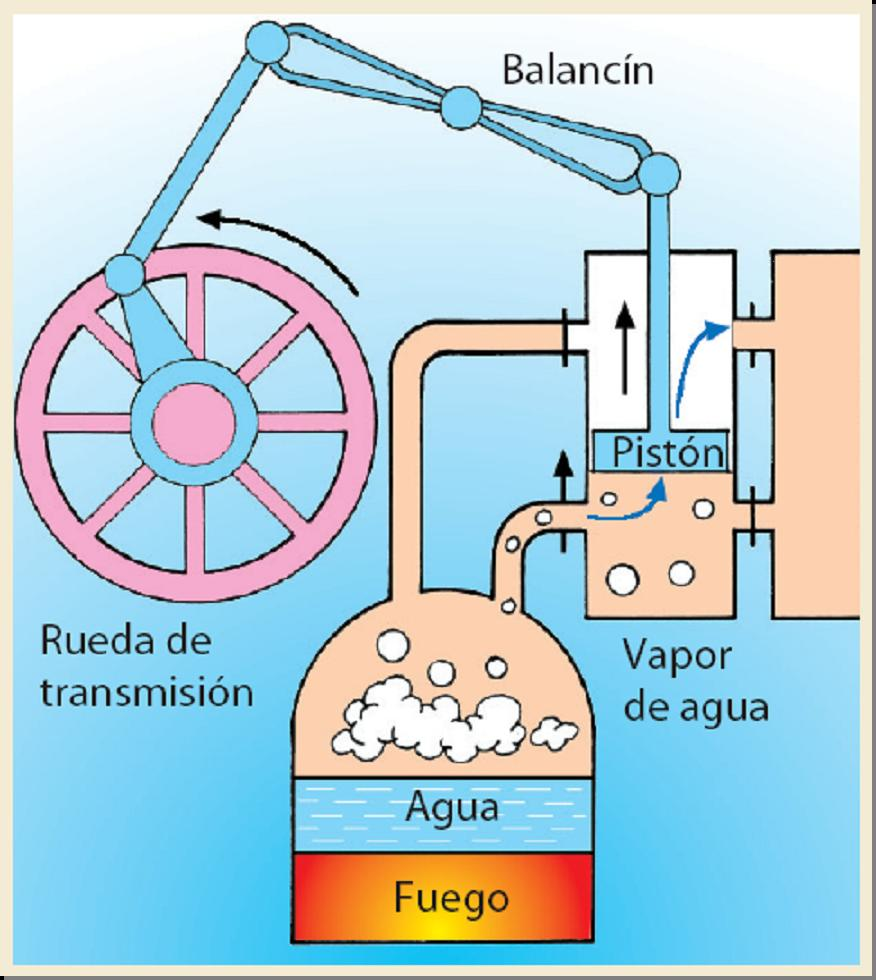
La capacidad de producir vapor a altas presiones, también debido a esta propiedad, es el fundamento de las máquinas de vapor, que mediante cambios de fase del agua son capaces de transformar la energía calorífica del carbón, u otro combustible, en energía mecánica.
La invención de la máquina de vapor por Watt en 1769, se considera en inicio de la segunda revolución industrial. Gracias al mismo principio se puede transformar energía calorífica en energía eléctrica, en las llamadas centrales térmicas, que, mediante la combustión de diferentes combustibles y la transformación en vapor a alta presión, permite mover turbinas qué unidas a generadores eléctricos, convierten la energía calorífica en electricidad.

Calor específico
El calor específico es la cantidad de calor necesario para elevar la temperatura de un gramo de un compuesto un grado centígrado, sin cambiar de estado. El calor específico del agua se toma como valor de referencia, asignándole el valor de 1,00 cal/g, este valor es uno de los mayores de todos los líquidos: amoniaco: 0,39 cal/g, benceno: 0,41; etanol: 0,58 cal/g. Esta propiedad le confiere la característica de ser uno de los mejores líquidos refrigerantes ya que debido a su elevada capacidad calorífica, le permite absorber grandes cantidades de energía calorífica sin cambiar en exceso su temperatura. Como refrigerante, tiene el inconveniente de que no se puede utilizar en zonas frías, pues al congelar con aumento de volumen, rompería las conducciones por las que circula.
Esta propiedad le confiere al agua un papel muy importante en la regulación del clima de la Tierra, ya que permite el almacenamiento del calor durante las horas de sol y liberación, lenta, durante la noche.
No compresible
Las moléculas de agua en estado líquido se encuentran a unas distancias que no pueden aproximarse debido a las fuerzas de atracción-repulsión que se establecen entre los dipolos de la molécula. El agua líquida puede considerarse prácticamente incompresible. A profundidades de 2 km, donde la presión alcanza unas 200 atm, el agua experimenta una disminución de volumen de solo un 1 %. Esta propiedad permite utilizar el agua como líquido en sistemas hidráulicos.
Viscosidad
La viscosidad dinámica de los líquidos, es una propiedad física, que mide su resistencia a fluir por un orificio, está directamente relacionada con la atracción entre sus moléculas. El valor de la viscosidad dinámica para el agua a 20ºC es 0,01 p (poise), en el caso de la miel que tiene grandes atracciones intermoleculares es siete veces mayor, en el caso de la gasolina con muy bajas interacciones moleculares el valor es 0,0065 p. Debido a la baja viscosidad y a su abundancia, las grandes masas de agua, se utilizan para obtener energía eléctrica, en centrales hidroeléctricas, aprovechando la energía potencial, que proporciona una gran masa de liquido a una importante diferencia de altura (E=mgh), que debido a su baja viscosidad, permite circular fácilmente por las conducciones del interior de las turbinas que mueven los generadores de electricidad. También se puede aprovechar el agua como sistema de almacenamiento de electricidad, ya que en momentos de poco consumo se puede elevar, mediante bombas eléctricas, grandes más de agua a ciertas alturas y hacerlas descender, para producir electricidad en momentos de mayor consumo eléctrico.

Otras propiedades secretas del agua
No conduce la electricidad. El agua pura se comporta como un material dieléctrico. Se denomina material dieléctrico al que no conduce la corriente eléctrica y puede ser utilizado como aislante eléctrico, esta propiedad se mide por la constante dieléctrica (ε). La constante dieléctrica del agua es muy elevada, ε=80,00 a 25 ºC, respecto a otros líquidos, etanol: 24,30 y benceno: 1,90 . El agua pura, sin ningún producto disuelto, se puede considerar aislante eléctrico. La presencia de compuestos iónicos disueltos en agua, implica la existencia de iones positivos y negativos y convierte el agua en conductora de la electricidad.
pH neutro. El agua puede disociarse espontáneamente en iones hidronios H3O+ e hidróxidos OH– según el equilibrio

La constante de disociación, de este equilibrio Kw = 10−14 a 25 °C lo que implica que está muy poco desplazado a la derecha, por lo que podemos considerar igual la concentración de H3O+ que el de OH– y por tanto el pH del agua pura es pH= 7,0 (neutro). La adición de pequeñas cantidades de ácido hace bajar drásticamente el valor del pH, por el contrario, si se añaden pequeñas cantidades de base, el pH sube drásticamente, hasta 14 como valor máximo. El agua “pura” que se maneja en el laboratorio nunca alcanza el valor de 7,0 ; oscila entre 6,5 y 8,5 debido a la existencia de restos de sales en disolución o CO2 del aire. Toda la química en medio acuoso, que es muy amplia y compleja, se basa en las diversas formas de desplazamiento del equilibrio iónico del agua.

Tensión Superficial. En estado líquido, las moléculas que están en el interior del líquido, están rodeadas por otras moléculas y por tanto sometidas a fuertes uniones por puentes de hidrógeno en todas las direcciones, sin embargo, las moléculas de agua que están en el exterior del líquido, en contacto con al aire, solo están atraídas por los puentes de hidrógeno de las moléculas del interior y esto origina un vector fuerza hacia el interior del líquido. A esta fuerza hacia el interior del agua se llama tensión superficial. Debido a estas fuerzas las gotas de agua tienen forma esférica, y ofrece resistencia a la deformación cuando cae una gota sobre ella. En el caso del agua, la tensión superficial tiene un valor de 72,80 dinas/cm, etanol: 22,3 y benceno: 28,9 dinas/cm

Adhesión. El agua contenida en tubo fino de vidrio, está sometida a dos tipos de fuerzas: cohesión, que son las fuerzas que mantienen unidas a las moléculas entre sí, debido a las fuerzas intermoleculares, por puentes de hidrógeno y adhesión que son las fuerzas las que se producen entre las moléculas del agua y los grupos OH de la superficie del. En el caso del agua la adhesión es mayor que la cohesión y las moléculas de agua ascienden ligeramente por las paredes del vidrio dando lugar a un menisco cóncavo, por el contrario, para el mercurio, que tiene valores muy bajos de adhesión y muy altos de cohesión el menisco es convexo.
El fenómeno de capilaridad, por la que el agua asciende por tubo muy fino, y puede llegar a las ramas más altas de los árboles, se debe a este tipo de fuerzas.
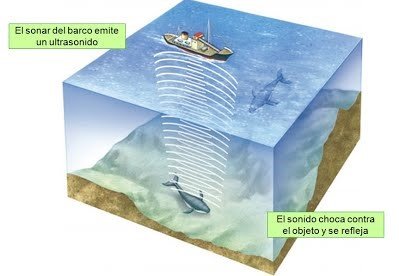
Transmisión del Sonido en el Agua. La propagación del sonido en el agua líquida, se realiza a una velocidad que varía entre los 1.400 y 1.540 m/s, dependiendo de la temperatura. Esta propiedad permite la comunicación submarina a largas distancias entre los cetáceos y es la base de la técnica del sonar, que permite detectar objetos bajo el agua.
Participa en múltiples reacciones químicas. La mayoría de industria química está basada en el agua, ya que la mayoría de las reacciones químicas se realizan en medio acuoso. La industria de la pintura, que tradicionalmente se realizaba en disolventes orgánicos, hoy día se realiza en medio acuoso. La industria de limpieza, se realiza mayoritariamente con agua o productos disueltos en ella, etc.
Ha quedado claro, que no existe vida sin agua, por lo que es evidente la importancia de su cuidado y conservación, en buen estado. En los días que se ha escrito este artículo, 27 de octubre de 2020, se publica en la prensa la confirmación definitiva de la existencia de agua en la luna.
Sobre el autor
Alfredo Negro Albañil. Doctor en Química. Profesor e investigador, durante más de 35 años en las Facultades de Veterinaria y Biología de la Universidad de León. Actualmente está jubilado y dedica parte de su tiempo a la divulgación científica en conferencias, prensa y otros medios.
Como citar este artículo:
APA: (2020-11-19). Los secretos del agua. Recuperado de https://quimicafacil.net/curiosidades-de-la-quimica/los-secretos-del-agua/
ACS: . Los secretos del agua. https://quimicafacil.net/curiosidades-de-la-quimica/los-secretos-del-agua/. Fecha de consulta 2026-02-17.
IEEE: , "Los secretos del agua," https://quimicafacil.net/curiosidades-de-la-quimica/los-secretos-del-agua/, fecha de consulta 2026-02-17.
Vancouver: . Los secretos del agua. [Internet]. 2020-11-19 [citado 2026-02-17]. Disponible en: https://quimicafacil.net/curiosidades-de-la-quimica/los-secretos-del-agua/.
MLA: . "Los secretos del agua." https://quimicafacil.net/curiosidades-de-la-quimica/los-secretos-del-agua/. 2020-11-19. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net