Tiempo de lectura estimado: 12 minutos
La toxina botulínica, o neurotoxina botulínica (BoNT), es una proteína neurotóxica producida por la bacteria Clostridium botulinum y especies relacionadas. También se conoce como Botulin, cuya densidad se predice que es de 1,5±0,1 g/cm3. Evita la liberación del neurotransmisor acetilcolina desde los terminales axónicos en la unión neuromuscular, causando así parálisis flácida. La toxina causa la enfermedad del botulismo. La toxina también se utiliza comercialmente con fines médicos y cosméticos.
Los siete principales tipos de toxina botulínica se denominan tipos A a G (A, B, C, D, E, F y G). Se encuentran ocasionalmente nuevos tipos. Los tipos A y B son capaces de causar enfermedades en humanos, y también se utilizan con fines comerciales y médicos. Los tipos C-G son menos comunes; los tipos E y F pueden causar enfermedades en humanos, mientras que los otros tipos causan enfermedades en otros animales.
Las toxinas botulínicas se encuentran entre las toxinas más potentes conocidas. La intoxicación puede ocurrir de forma natural como resultado de una infección por herida o intestinal o al ingerir la toxina formada en los alimentos. La dosis letal estimada en humanos de la toxina de tipo A es de 1,3-2,1 ng/kg por vía intravenosa o intramuscular, de 10-13 ng/kg cuando se inhala, o de 1000 ng/kg cuando se toma por vía oral.
Las formas comerciales se comercializan bajo los nombres de marca Botox (onabotulinumtoxinA), Dysport/Azzalure (abobotulinumtoxinA), Letybo (letibotulinumtoxinA), Myobloc (rimabotulinumtoxinB), Xeomin/Bocouture (incobotulinumtoxinA) y Jeuveau (prabotulinumtoxinA).
Historia de la toxina botulinica
Descubrimiento del Clostridium botulinum
Una de las primeras epidemias registradas de botulismo alimentario ocurrió en 1793 en la aldea de Wildbad, en lo que ahora es Baden-Württemberg, Alemania. Trece personas se enfermaron y seis murieron después de comer estómago de cerdo relleno de morcilla, una comida local.
Casos adicionales de envenenamiento alimentario fatal en Württemberg llevaron a las autoridades a emitir una advertencia pública contra el consumo de morcillas ahumadas en 1802 y a recopilar informes de casos de «envenenamiento por morcilla».
Entre 1817 y 1822, el médico alemán Justinus Kerner publicó la primera descripción completa de los síntomas del botulismo, basada en extensas observaciones clínicas y experimentos con animales. Concluyó que la toxina se desarrolla en las morcillas malas en condiciones anaeróbicas, es una sustancia biológica, actúa sobre el sistema nervioso y es letal incluso en cantidades pequeñas.
Kerner hipotetizó que esta «toxina de morcilla» podría ser utilizada para tratar una variedad de enfermedades causadas por un sistema nervioso hiperactivo, convirtiéndose en el primero en sugerir que podría ser utilizado terapéuticamente. En 1870, el médico alemán Müller acuñó el término «botulismo» para describir la enfermedad causada por el envenenamiento por morcilla, del término latino botulus, que significa «morcilla».
Relación con los cárnicos
En 1895, Émile van Ermengem, microbiólogo belga, descubrió lo que ahora se llama Clostridium botulinum y confirmó que una toxina producida por las bacterias causa botulismo. El 14 de diciembre de 1895, hubo un gran brote de botulismo en la aldea belga de Ellezelles que ocurrió en un funeral donde la gente comió jamón encurtido y ahumado; tres de ellos murieron. Al examinar el jamón contaminado y realizar autopsias en las personas que murieron después de comerlo, Van Ermengem aisló un microorganismo anaeróbico que llamó Bacillus botulinus.
También realizó experimentos en animales con extractos de jamón, cultivos bacterianos y extractos de toxinas de las bacterias. A partir de esto, concluyó que las bacterias en sí mismas no causan botulismo alimentario, sino que producen una toxina que causa la enfermedad después de ser ingerida. Como resultado de la investigación de Kerner y Van Ermengem, se pensó que solo la carne o el pescado contaminados podían causar botulismo.
Esta idea fue refutada en 1904 cuando ocurrió un brote de botulismo en Darmstadt, Alemania, debido a frijoles blancos enlatados. En 1910, el microbiólogo alemán J. Leuchs publicó un artículo que mostraba que los brotes en Ellezelles y Darmstadt fueron causados por diferentes cepas de Bacillus botulinus y que las toxinas eran serológicamente distintas. En 1917, Bacillus botulinus fue renombrado como Clostridium botulinum, ya que se decidió que el término Bacillus solo debería referirse a un grupo de microorganismos aeróbicos, mientras que Clostridium solo se usaría para describir un grupo de microorganismos anaeróbicos. En 1919, Georgina Burke utilizó reacciones de toxina-antitoxina para identificar dos cepas de Clostridium botulinum, que designó como A y B.
Comida enlatada
Durante las tres décadas siguientes, de 1895 a 1925, mientras la conserva de alimentos se acercaba a convertirse en una industria que generaba mil millones de dólares al año, el botulismo se estaba convirtiendo en un riesgo para la salud pública. Karl Friedrich Meyer, un científico veterinario suizo-americano, creó un centro en la Fundación Hooper en San Francisco, donde desarrolló técnicas para cultivar el organismo y extraer la toxina, y viceversa, para prevenir el crecimiento del organismo y la producción de la toxina, e inactivar la toxina mediante calentamiento. De esta manera, la industria de conservas de California se preservó.
Toxina botulínica y WWII
Con el estallido de la Segunda Guerra Mundial, se investigó la posibilidad de usar la toxina botulínica como arma en Fort Detrick, Maryland. Carl Lamanna y James Duff desarrollaron las técnicas de concentración y cristalización que Edward J. Schantz utilizó para crear el primer producto clínico.
Cuando el Cuerpo Químico del Ejército fue disuelto, Schantz se trasladó al Instituto de Investigación de Alimentos en Wisconsin, donde fabricó la toxina para uso experimental y la proporcionó a la comunidad académica.
El mecanismo de acción de la toxina botulínica, que consiste en bloquear la liberación del neurotransmisor acetilcolina en las terminaciones nerviosas, se dilucidó a mediados del siglo XX y sigue siendo un tema importante de investigación. Casi todos los tratamientos con toxina se basan en este efecto en varios tejidos del cuerpo.
Primeros usos en la medicina del botox
Los oftalmólogos especializados en trastornos de los músculos oculares (estrabismo) habían desarrollado el método de inyección guiada por EMG (utilizando el electromiograma, la señal eléctrica de un músculo activado, para guiar la inyección) de anestésicos locales como técnica diagnóstica para evaluar la contribución de un músculo individual al movimiento ocular.
Debido a que la cirugía de estrabismo a menudo necesitaba repetirse, se emprendió una búsqueda de tratamientos de inyección no quirúrgicos utilizando varios anestésicos, alcoholes, enzimas, bloqueadores de enzimas y neurotoxinas de serpientes.
Finalmente, inspirado por el trabajo de Daniel B. Drachman con pollos en Johns Hopkins, Alan B. Scott y sus colegas inyectaron toxina botulínica en los músculos extraoculares de un mono. El resultado fue notable: unos pocos picogramos indujeron una parálisis que se limitó al músculo objetivo, duradera y sin efectos secundarios.
Después de desarrollar técnicas de liofilización, amortiguación con albúmina y asegurarse de la esterilidad, potencia y seguridad, Scott solicitó la aprobación de la FDA para el uso de drogas en investigación y comenzó a fabricar neurotoxina botulínica de tipo A en su laboratorio de San Francisco. Inyectó a los primeros pacientes de estrabismo en 1977, informó su utilidad clínica en 1980 y pronto capacitó a cientos de oftalmólogos en la inyección guiada por EMG del medicamento que llamó Oculinum («alineador de ojos»).
En 1986, Oculinum Inc., la micromultinacional de Scott y distribuidora de la toxina botulínica, no pudo obtener un seguro de responsabilidad civil y ya no pudo suministrar el medicamento. A medida que los suministros se agotaban, los pacientes que habían llegado a depender de inyecciones periódicas se volvieron desesperados. Durante cuatro meses, mientras se resolvían los problemas de responsabilidad, los pacientes estadounidenses de blefaroespasmo viajaron a centros oftalmológicos canadienses para recibir sus inyecciones.
Basándose en datos de miles de pacientes recopilados por 240 investigadores, Oculinum Inc. (que pronto fue adquirida por Allergan) recibió la aprobación de la FDA en 1989 para comercializar Oculinum para uso clínico en los Estados Unidos para tratar el estrabismo en adultos y el blefaroespasmo. Allergan luego comenzó a usar el nombre comercial Botox. Esta aprobación original se otorgó en virtud de la Ley de Medicamentos Huérfanos de los Estados Unidos de 1983.
Usos cosméticos
El efecto de la toxina botulínica tipo A en la reducción y eliminación de arrugas en la frente fue descrito y publicado por primera vez por Richard Clark, MD, un cirujano plástico de Sacramento, California.
En 1987, Clark se enfrentó al desafío de eliminar la desfiguración causada por el funcionamiento solo del lado derecho de los músculos de la frente después de que el lado izquierdo de la frente quedara paralizado durante un procedimiento de lifting facial. Esta paciente había deseado lucir mejor después de su lifting, pero estaba experimentando una elevación unilateral extraña de la ceja derecha de la frente mientras que la ceja izquierda estaba caída, y constantemente demostraba profundas arrugas expresivas en la frente derecha mientras que el lado izquierdo estaba perfectamente liso debido a la parálisis.
Clark sabía que la toxina botulínica se estaba usando de manera segura para tratar a bebés con estrabismo y solicitó y obtuvo la aprobación de la FDA para experimentar con la toxina botulínica para paralizar los músculos normales en movimiento y arrugamiento de la frente derecha para hacer que ambos lados de la frente parecieran iguales.
Este estudio e informe de caso del uso cosmético de la toxina botulínica para tratar una complicación cosmética de una cirugía cosmética fue el primer informe sobre el tratamiento específico de las arrugas y fue publicado en la revista Plastic and Reconstructive Surgery en 1989. Los editores de la revista de la Sociedad Estadounidense de Cirujanos Plásticos han afirmado claramente que «el primer uso descrito de la toxina en circunstancias estéticas fue por Clark y Berris en 1989».
Jean y Alastair Carruthers observaron que los pacientes con blefaroespasmo que recibieron inyecciones alrededor de los ojos y la parte superior de la cara también disfrutaron de una disminución de las líneas glabella faciales («líneas del ceño fruncido» entre las cejas). Alastair Carruthers informó que otros en ese momento también notaron estos efectos y discutieron el potencial cosmético de la toxina botulínica.
A diferencia de otros investigadores, los Carruthers hicieron más que solo hablar sobre la posibilidad de usar la toxina botulínica con fines cosméticos. Realizaron un estudio clínico en personas por lo demás normales cuya única preocupación era su ceño fruncido. Realizaron su estudio durante 1987-1989 y presentaron sus resultados en la reunión anual de 1990 de la Sociedad Estadounidense de Cirugía Dermatológica. Sus hallazgos fueron posteriormente publicados en 1992.
Uso en el tratamiento del dolor crónico
William J. Binder informó en 2000 de que los pacientes que se habían sometido a inyecciones cosméticas alrededor de la cara habían notado un alivio de la cefalea crónica. Inicialmente se pensó que se trataba de un efecto indirecto de la reducción de la tensión muscular, pero ahora se sabe que la toxina inhibe la liberación de neurotransmisores nociceptivos periféricos, suprimiendo los sistemas centrales de procesamiento del dolor responsables de la cefalea migrañosa.
Mecanismo de acción
La toxina botulínica ejerce su efecto al cortar proteínas clave necesarias para la activación nerviosa. En primer lugar, la toxina se une específicamente a la superficie presináptica de las neuronas que utilizan el neurotransmisor acetilcolina.
Una vez unida a la terminal nerviosa, la neurona toma la toxina en una vesícula por endocitosis mediada por receptores. A medida que la vesícula se mueve más hacia el interior de la célula, se acidifica, activando una porción de la toxina que la hace empujar a través de la membrana de la vesícula y hacia el citoplasma de la célula.
Las neurotoxinas botulínicas reconocen simultáneamente distintas clases de receptores (gangliósidos, sinaptotagmina y SV2). Una vez dentro del citoplasma, la toxina corta proteínas SNARE (proteínas que median la fusión de las vesículas con sus compartimentos de membrana diana), lo que significa que las vesículas de acetilcolina no pueden unirse a la membrana celular intracelular, evitando que la célula libere vesículas de neurotransmisor. Esto detiene la señalización nerviosa, lo que conduce a la parálisis flácida.
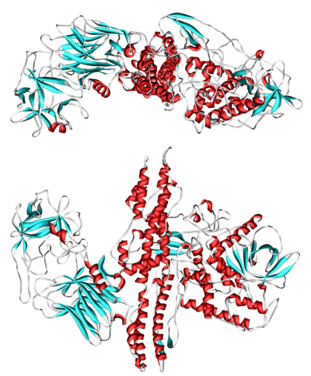
La toxina en sí misma es liberada de la bacteria como una cadena única, luego se activa cuando es cortada por sus propias proteasas. La forma activa consiste en una proteína de dos cadenas compuesta por una polipeptida de cadena pesada de 100 kDa unida mediante un enlace disulfuro a una polipeptida de cadena ligera de 50 kDa.
La cadena pesada contiene dominios con varias funciones; tiene el dominio responsable de unirse específicamente a las terminales nerviosas presinápticas, así como el dominio responsable de mediar la translocación de la cadena ligera hacia el citoplasma celular a medida que la vacuola se acidifica.
La cadena ligera es una metaloproteasa de zinc de la familia M27 y es la parte activa de la toxina. Se transloca al citoplasma de la célula hospedera donde corta la proteína hospedera SNAP-25, un miembro de la familia de proteínas SNARE, que es responsable de la fusión. La SNAP-25 cortada no puede mediar la fusión de las vesículas con la membrana celular del hospedero, evitando así la liberación del neurotransmisor acetilcolina desde las terminaciones axónicas. Este bloqueo se revierte lentamente a medida que la toxina pierde actividad y las proteínas SNARE se regeneran lentamente por la célula afectada.
Los siete serotipos de toxina (A-G) se separan tradicionalmente por su antigenicidad. Tienen diferentes estructuras terciarias y diferencias de secuencia. Mientras que los diferentes tipos de toxina apuntan a miembros de la familia SNARE, diferentes tipos de toxina apuntan a diferentes miembros de la familia SNARE.
Los serotipos A, B y E causan botulismo humano, con las actividades de los tipos A y B que perduran más tiempo in vivo (de varias semanas a meses). Los tipos de toxina existentes pueden recombinarse para crear tipos «híbridos» (mosaicos, quiméricos). Ejemplos incluyen BoNT/CD, BoNT/DC y BoNT/FA, siendo la primera letra el tipo de cadena ligera y la última el tipo de cadena pesada. BoNT/FA recibió considerable atención bajo el nombre de «BoNT/H», ya que se pensaba erróneamente que no podía ser neutralizada por ninguna antitoxina existente.
Las toxinas botulínicas están estrechamente relacionadas con la toxina del tétanos; ambas se conocen colectivamente como neurotoxinas de Clostridium y la cadena ligera se clasifica por MEROPS como familia M27. Los tipos no clásicos incluyen BoNT/X (P0DPK1), que es tóxico en ratones y posiblemente en humanos; un BoNT/J (A0A242DI27) encontrado en Enterococcus de vaca; y un BoNT/Wo (A0A069CUU9) encontrado en Weissella oryzae que coloniza el arroz.
Para más información Botulinum Toxin
Como citar este artículo:
APA: (2023-10-03). Toxina botulínica. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/toxina-botulinica/
ACS: . Toxina botulínica. https://quimicafacil.net/compuesto-de-la-semana/toxina-botulinica/. Fecha de consulta 2026-02-22.
IEEE: , "Toxina botulínica," https://quimicafacil.net/compuesto-de-la-semana/toxina-botulinica/, fecha de consulta 2026-02-22.
Vancouver: . Toxina botulínica. [Internet]. 2023-10-03 [citado 2026-02-22]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/toxina-botulinica/.
MLA: . "Toxina botulínica." https://quimicafacil.net/compuesto-de-la-semana/toxina-botulinica/. 2023-10-03. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net