Tiempo de lectura estimado: 7 minutos
El pentacloruro de arsénico es un compuesto químico de arsénico y cloro, que hasta hace unas décadas se consideraba como imposible de sintetizar. Este compuesto se preparó por primera vez en 1976 mediante la irradiación UV del tricloruro de arsénico, AsCl3, en cloro líquido a -105 °C.
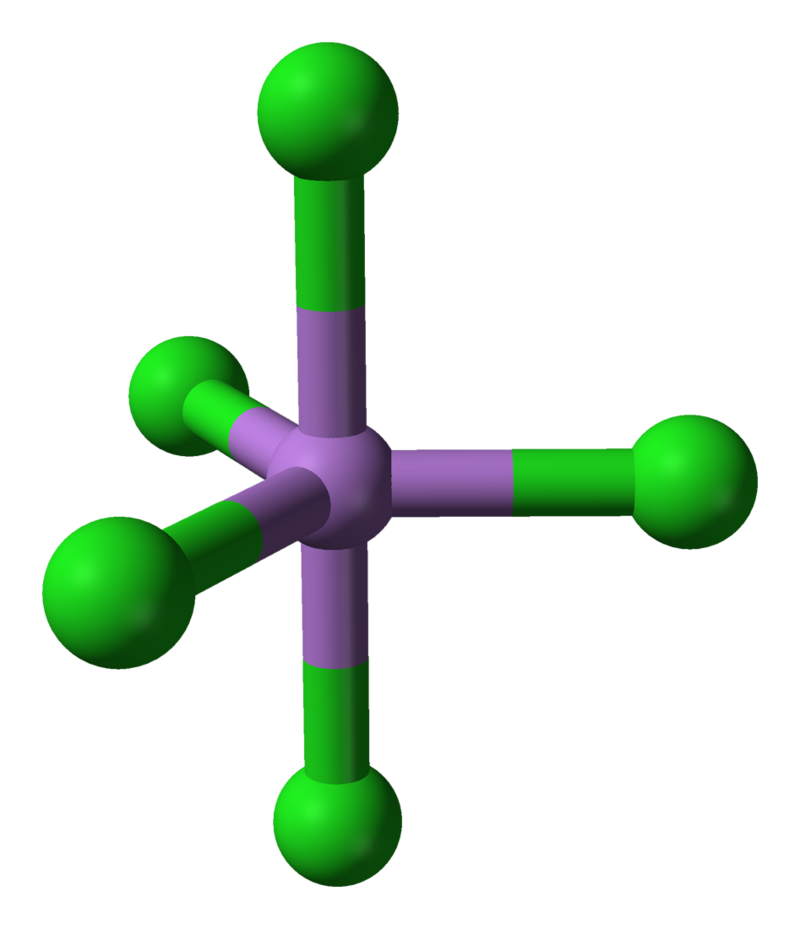
El AsCl5 se descompone a unos -50 °C. La estructura del sólido se determinó finalmente en 2001. El AsCl5 es similar al pentacloruro de fósforo, PCl5 por tener una estructura bipiramidal trigonal donde los enlaces ecuatoriales son más cortos que los enlaces axiales (As-Cleq = 210,6 pm, 211,9 pm; As-Clax= 220,7 pm).
Los pentacloruros de los elementos por encima y por debajo del arsénico en el grupo 15, el pentacloruro de fósforo y el pentacloruro de antimonio son mucho más estables y la inestabilidad del AsCl5 parece anómala. Se cree que la causa se debe a un apantallamiento incompleto del núcleo en los elementos 4p después de la primera serie de transición (es decir, galio, germanio, arsénico, selenio, bromo y criptón), lo que lleva a la estabilización de sus electrones 4s, haciéndolos menos disponibles para la unión. Este efecto se ha denominado contracción del bloque d y es similar a la contracción del bloque f que normalmente se denomina contracción lantánida.
Historia de una síntesis imposible
En 1976, el químico alemán Konrad Seppelt (derecha) encontró que podía prepararse si una mezcla fría de AsCl3 y Cl2 era irradiada con luz UV a -100°C
Se descompone a temperaturas superiores a -60°C.
¿Por qué funciona este método? La luz UV divide la molécula de cloro en átomos de cloro reactivos, que pueden combinarse con el AsCl3 para formar moléculas de AsCl5 que no tienen suficiente energía para separarse de nuevo.
Estabilidad del pentacloruro de arsénico
En su estudio original, Seppelt examinó el espectro vibratorio (Raman) de la mezcla de reacción a intervalos regulares para determinar la formación del pentacloruro de arsénico. A medida que pasaba el tiempo, el espectro cambió del de AsCl3 a una característica de AsCl5, pareciéndose a los conocidos espectros de PCl5 y SbCl5. Sin embargo, el factor decisivo es que ahora se conoce la estructura del AsCl5.
Un cuarto de siglo después de su descubrimiento original, Seppelt y su estudiante Silvia Haupt lograron hacer cristales amarillos de esta sustancia inestable a -125°C por cristalización de soluciones en CHFCl2. Los estudios de difracción de rayos X muestran que tiene la esperada estructura bipiramidal trigonal en estado sólido. Las distancias axiales de As-Cl son de 220,7 pm, mientras que los enlaces ecuatoriales de As-Cl son de 210,6 y 211,9 (con un promedio de 211,45) pm.
Estructura
Los enlaces As-Cl en la estructura del pentacloruro de arsénico tienen diferentes características. Los pares de electrones en los enlaces «axiales» tienen tres repulsiones de 90° con los pares de electrones en los enlaces «ecuatoriales», mientras que los pares de electrones en los enlaces ecuatoriales tienen sólo dos repulsiones de 90°. Por lo tanto, se podría predecir que las repulsiones que implican los vínculos axiales serían más fuertes y que estos vínculos serían por lo tanto más largos, como es el caso.
Pero no es un caso único. El AsF5AsF5 también tiene una estructura bipiramidal trigonal, con As-F (axial) 171,9 pm y As-F (ecuatorial) 166,8 pm en la fase gaseosa. Las moléculas de AsF5 también están presentes en los cristales, teniendo As-F (axial) 171,1 pm y As-F (ecuatorial) 165,6 pm.
El PF5PF5 tiene una estructura similar. Las moléculas de PF5 en fase gaseosa tienen una estructura D3h (P-F (axial) 158 pm y P-F (ecuatorial) 153 pm; en estado sólido a -164°C, P-F (axial) es 158,0 pm y P-F (ecuatorial) es 152,2 pm.
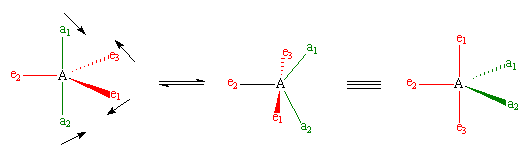
Sin embargo, cuando los químicos estudiaron el espectro de RMN de 19F del PF5, vieron sólo una señal, incluso a -100°C, que mostraba que sólo había un entorno para los flúor, que no es lo que se predijo. Se ha sugerido que hay un intercambio de átomos de flúor entre las posiciones axial y ecuatorial que es rápido en la escala de tiempo de la RMN, la llamada pseudorotación de Berry (ver imagen abajo), que procede a través de un intermedio piramidal cuadrado. En este proceso, dos enlaces ecuatoriales (mostrados en rojo) se alejan el uno del otro y se convierten en enlaces axiales, al mismo tiempo que los enlaces axiales (en verde) se mueven juntos para convertirse en ecuatoriales.
Sin embargo, la estructura del PCl5 es aún más complicada. En la fase gaseosa, contiene efectivamente moléculas de PCl5, con P-Cl (axial) = 212,4 pm y P-Cl (ecuatorial) = 201,7 pm. Sin embargo, los cristales de PCl5 están compuestos de iones [PCl4]+ y [PCl6]–. (El P-Cl en los iones tetraédricos [PCl4]+ es de 190 pm mientras que el P-Cl en los iones octaédricos [PCl6]– es de 211-216 pm).
Además de eso, también se conoce una fase de estado sólido metaestable que tiene la estructura [PCl4+]2 [PCl6–] Cl–.
En disolventes polares como el MeCN, el MeNO2 o el CCl4, está formado por moléculas monoméricas PCl5 en asociación con un dímero.
En el caso del pentabromuro de fosforo tiende a cambiar a una mezcla de PBr3 y Br2 en la fase gaseosa, mientras que, en el estado sólido, el PBr5 está hecha de iones PBr4+ y Br–. Las longitudes de enlace P-Br en los iones PBr4+ son de 213 a 217 pm. Debido a que son más grandes que los átomos de cloro, parece que seis bromos no pueden adherirse al mismo átomo de fósforo, hay demasiadas repulsiones no adherentes.
El pentayoduro de fosforo es mas esquivo. En 1978, se informó de que se había hecho, como cristales negro-marrón, a partir de la reacción de PCl5 (en solución en CH3I) y MI (M = Li, Na o K). Sin embargo, hasta ahora no hay informes confirmatorios de su estructura.
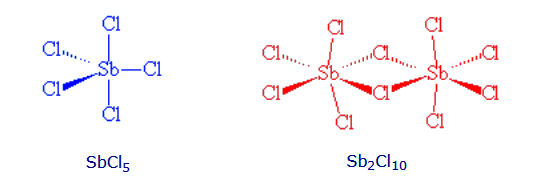
El pentacloruro de arsénico, es relativamente simple. El SbCl5, que es estable hasta los 140°C, puede hacerse fácilmente a partir de la reacción del SbCl3 y el Cl2. Sin embargo, mientras que el SbCl5 sólido tiene la estructura molecular esperada a temperatura ambiente, por debajo de -54,1°C cambia reversiblemente a una molécula dimérica, Cl4Sb(μm-Cl)2SbCl4. En las moléculas de SbCl5, las distancias (axiales) de Sb-Cl son 233,3 pm y las distancias (ecuatoriales) de Sb-Cl son 227,04 pm.
El antimonio es un átomo más grande que el arsénico, por lo que no es sorprendente que le resulte más fácil acomodar seis átomos de cloro a su alrededor. Es posible que el AsCl5 pueda dimerizar a muy bajas temperaturas, ya que se conocen seis especies de coordenadas [AsCl6] y [AsCl5(Me3PO)].
La estabilidad del pentacloruro de arsénico se ha atribuido a la estabilización de un par de electrones 4s2 en los elementos que siguen a los metales de transición 3d, causado por el blindaje incompleto del núcleo que reduce la energía de la órbita 4s y hace más difícil promover los electrones 4s. Así que el AsCl3 es más estable que el AsCl5. Se ha dado una razón similar para otras facetas del comportamiento de estos elementos, como la dificultad para hacer el ión perbromato.
Para más información Pentachloroarsorane
Como citar este artículo:
APA: (2021-11-16). Pentacloruro de arsénico. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/pentacloruro-de-arsenico/
ACS: . Pentacloruro de arsénico. https://quimicafacil.net/compuesto-de-la-semana/pentacloruro-de-arsenico/. Fecha de consulta 2026-03-03.
IEEE: , "Pentacloruro de arsénico," https://quimicafacil.net/compuesto-de-la-semana/pentacloruro-de-arsenico/, fecha de consulta 2026-03-03.
Vancouver: . Pentacloruro de arsénico. [Internet]. 2021-11-16 [citado 2026-03-03]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/pentacloruro-de-arsenico/.
MLA: . "Pentacloruro de arsénico." https://quimicafacil.net/compuesto-de-la-semana/pentacloruro-de-arsenico/. 2021-11-16. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net