Tiempo de lectura estimado: 5 minutos
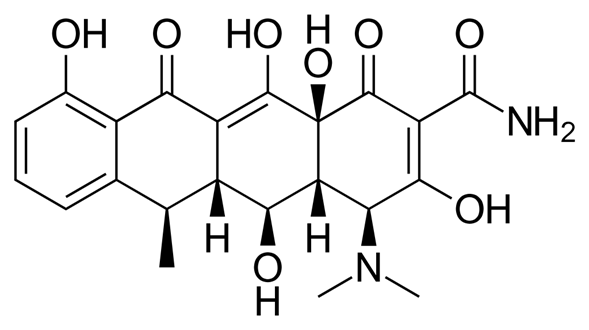
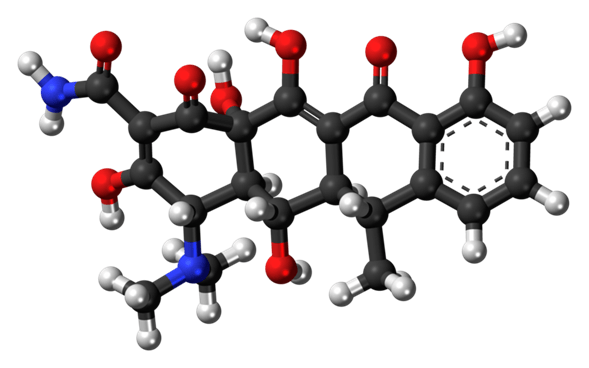
La doxiciclina es un antibiótico de amplio espectro de la clase de las tetraciclinas utilizado en el tratamiento de infecciones causadas por bacterias y ciertos parásitos. Se usa para tratar la neumonía bacteriana, el acné, las infecciones por clamidia, la enfermedad de Lyme, el cólera, el tifus y la sífilis. También se utiliza para prevenir la malaria en combinación con la quinina. La doxiciclina se puede tomar por vía oral o por inyección en una vena.
Los efectos secundarios comunes incluyen diarrea, náuseas, vómitos, dolor abdominal y un mayor riesgo de quemaduras solares. No se recomienda su uso durante el embarazo. Al igual que otros agentes de la clase de las tetraciclinas, la doxiciclina ralentiza o mata a las bacterias al inhibir la producción de proteínas. Mata la malaria al dirigirse a un orgánulo plástido, el apicoplasto.
Historia
Después de que la penicilina revolucionara el tratamiento de las infecciones bacterianas en la Segunda Guerra Mundial, muchas compañías químicas se adentraron en el campo del descubrimiento de antibióticos mediante la bioprospección. American Cyanamid fue una de ellas, y a finales de la década de 1940 los químicos de allí descubrieron la clortetraciclina, el primer miembro de la clase de los antibióticos tetraciclinas. Poco después, los científicos de Pfizer descubrieron la terramicina y la llevaron al mercado.
Ambos compuestos, al igual que la penicilina, eran productos naturales y se creía comúnmente que la naturaleza los había perfeccionado, y que cambios químicos posteriores solo podrían degradar su eficacia. Los científicos de Pfizer liderados por Lloyd Conover modificaron estos compuestos, lo que llevó a la invención de la propia tetraciclina, el primer antibiótico semisintético.
El grupo de Charlie Stephens en Pfizer trabajó en más análogos y creó uno con una estabilidad y eficacia farmacológica mucho mejoradas: la doxiciclina. Fue desarrollada clínicamente a principios de la década de 1960 y aprobada por la FDA en 1967.
Patente
A medida que su patente se acercaba a su vencimiento a principios de la década de 1970, la patente se convirtió en objeto de una demanda entre Pfizer e International Rectifier que no se resolvió hasta 1983; en ese momento fue el caso de patente litigada más grande de la historia de EE. UU. En lugar de un pago en efectivo por infracción, Pfizer tomó los negocios veterinarios y de aditivos alimentarios de la subsidiaria de International Rectifier, Rachelle Laboratories.
En enero de 2013, la FDA informó de escasez de algunas, pero no todas, las formas de doxiciclina «causadas por un aumento de la demanda y problemas de fabricación». Las empresas involucradas incluyeron a un importante fabricante de genéricos no identificado que cesó su producción en febrero de 2013, Teva (que cesó su producción en mayo de 2013), Mylan, Actavis y Hikma Pharmaceuticals. La escasez llegó en un momento especialmente malo, ya que también había escasez de un antibiótico alternativo, la tetraciclina, al mismo tiempo. El precio de mercado de la doxiciclina aumentó drásticamente en los Estados Unidos en 2013 y principios de 2014 (de $20 a más de $1800 por una botella de 500 tabletas), antes de disminuir de nuevo.
Química de la doxiciclina
La doxiciclina, el monohidrato de doxiciclina y el hiclato de doxiciclina son polvos amarillos y cristalinos de sabor amargo. Este último huele ligeramente a etanol, una solución acuosa al 1% tiene un pH de 2-3, y la rotación específica es D 25 {\displaystyle _{D}^{25}} -110° cm3/dm-g en ácido clorhídrico metanólico 0,01 N.
Síntesis
En 2005, el grupo de Andrew Myers de la Universidad de Harvard describió una síntesis de 18 pasos, partiendo del ácido benzoico.
El ácido benzoico forma la base del anillo B de la doxiciclina, alrededor del cual se agregan los anillos A, C y D mediante diversas reacciones de formación de anillos. Primero, el ácido benzoico se somete a una dihidroxilación microbiana, seguida de pasos adicionales que incluyen epoxidación y la introducción de grupos protectores de terc-butil dimetilsililo (TBS) para producir un epóxidoester enantioméricamente puro.
Luego se agrega un isoxazol sustituido con dimetilamino desprotonado y se produce el cierre del anillo en las reacciones sucesivas con triflato de litio, lo que genera el anillo A, y el ácido trifluoroacético elimina un grupo TBS. Los anillos C y D se agregaron mediante una reacción de acoplamiento con otro reactivo carbonaniónico mediante una secuencia Michael-Dieckmann. La eliminación de los grupos protectores (TBS = terc-butil dimetilsililo; BOC = terc-butiloxicarbonilo, COtC4H9) produjo la doxiciclina, de manera estereoselectiva. El rendimiento de esta virtuosa demostración de química orgánica sintética fue del 8,3%.
Modo de acción
Las tetraciclinas inhiben la síntesis de proteínas bacterianas. Se unen a la parte 16S de la subunidad 30S del ribosoma e interfieren con la unión del tRNA aminoacilado, deteniendo la lectura del codón del ARNm por el anticodón del tRNA. Este es un paso clave de la síntesis de proteínas y significa que no se pueden agregar nuevos aminoácidos a la cadena polipeptídica incipiente. Esto explica por qué las tetraciclinas son efectivas contra una amplia gama de bacterias tanto gram-positivas como gram-negativas.
Para más información Doxycycline
Como citar este artículo:
APA: (2023-07-11). Doxiciclina. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/doxiciclina/
ACS: . Doxiciclina. https://quimicafacil.net/compuesto-de-la-semana/doxiciclina/. Fecha de consulta 2026-03-03.
IEEE: , "Doxiciclina," https://quimicafacil.net/compuesto-de-la-semana/doxiciclina/, fecha de consulta 2026-03-03.
Vancouver: . Doxiciclina. [Internet]. 2023-07-11 [citado 2026-03-03]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/doxiciclina/.
MLA: . "Doxiciclina." https://quimicafacil.net/compuesto-de-la-semana/doxiciclina/. 2023-07-11. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net