Actualizado en enero 23, 2024
Tiempo de lectura estimado: 13 minutos
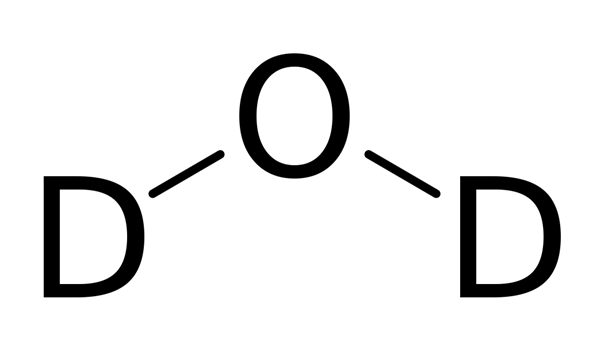
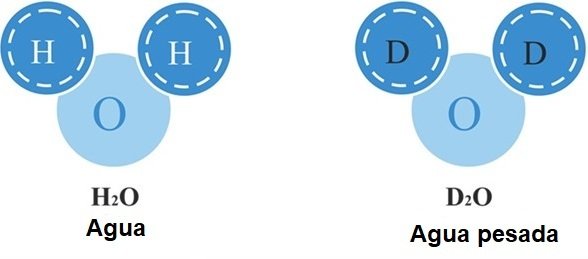
El agua pesada (óxido de deuterio, 2H2O, D2O) es una forma de agua que contiene sólo deuterio (2H o D, también conocido como hidrógeno pesado) en lugar del isótopo común hidrógeno-1 (1H). La presencia del isótopo de hidrógeno más pesado confiere al agua propiedades nucleares diferentes, y el aumento de su masa le confiere propiedades físicas y químicas ligeramente distintas a las del agua normal.
Descubrimiento de agua pesada
El científico estadounidense y premio Nobel Harold Urey descubrió el isótopo deuterio en 1931 y más tarde logró concentrarlo en agua. El mentor de Urey, Gilbert Newton Lewis, aisló la primera muestra de agua pesada pura por electrólisis en 1933. George de Hevesy y Erich Hofer utilizaron agua pesada en 1934 en uno de los primeros experimentos de trazadores biológicos, para estimar la tasa de renovación del agua en el cuerpo humano.
Sello postal de Rumania en honor al descubridor del agua pesada, Harold Urey
Emilian Bratu y Otto Redlich estudiaron la autodisociación del agua pesada en 1934.
Características químicas
El deuterio es un isótopo del hidrógeno con un núcleo que contiene un neutrón y un protón; el núcleo de un átomo de protio (hidrógeno normal) está formado sólo por un protón. El neutrón adicional hace que un átomo de deuterio sea aproximadamente el doble de pesado que un átomo de protio.
Una molécula de agua pesada tiene dos átomos de deuterio en lugar de los dos átomos de protio del agua «ligera» ordinaria. El término agua pesada, tal y como se define en el Goldbook de la IUPAC, también puede referirse al agua en la que una proporción mayor de lo habitual de átomos de hidrógeno son deuterio en lugar de protio. Como ejemplo, el agua ordinaria (el «agua ordinaria» utilizada para un patrón de deuterio) contiene sólo unos 156 átomos de deuterio por millón de átomos de hidrógeno, lo que significa que el 0,0156% de los átomos de hidrógeno son del tipo pesado.
Así pues, el agua pesada, tal como la define la IUPAC, incluye el óxido de hidrógeno-deuterio (HDO) y otras mezclas de D2O, H2O y HDO en las que la proporción de deuterio es superior a la habitual. Por ejemplo, el agua pesada utilizada en los reactores CANDU es una mezcla de agua altamente enriquecida que contiene principalmente óxido de deuterio D2O, pero también algo de óxido de hidrógeno-deuterio (HDO) y una cantidad menor de óxido de hidrógeno ordinario H2O.
El agua pesada en el sentido del IUPAC Goldbook no tiene por qué estar tan altamente enriquecida. Sin embargo, el peso de una molécula de agua pesada no difiere sustancialmente del de una molécula de agua normal, ya que aproximadamente el 89% del peso molecular del agua procede del único átomo de oxígeno en lugar de los dos átomos de hidrógeno.
El agua pesada no es radiactiva. En su forma pura, tiene una densidad aproximadamente un 11% superior a la del agua, pero por lo demás es física y químicamente similar. Sin embargo, las diferencias en el agua que contiene deuterio (especialmente las que afectan a las propiedades biológicas) son mayores que en cualquier otro compuesto isotópico común, ya que el deuterio es el único isótopo pesado estable dos veces más pesado que el isótopo más ligero.
Esta diferencia aumenta la fuerza de los enlaces hidrógeno-oxígeno del agua, lo que a su vez basta para provocar diferencias importantes para algunas reacciones bioquímicas. El cuerpo humano contiene de forma natural deuterio equivalente a unos cinco gramos de agua pesada, que es inofensiva. Cuando una gran fracción del agua (> 50%) en organismos superiores se sustituye por agua pesada, el resultado es la disfunción y muerte de la célula.
Agua pesada e industria nuclear
El agua pesada se produjo por primera vez en 1932, pocos meses después del descubrimiento del deuterio. Con el descubrimiento de la fisión nuclear a finales de 1938, y la necesidad de un moderador de neutrones que capturara pocos neutrones, el agua pesada se convirtió en un componente de las primeras investigaciones sobre energía nuclear.
Desde entonces, el agua pesada ha sido un componente esencial en algunos tipos de reactores, tanto los que generan energía como los diseñados para producir isótopos para armas nucleares. Estos reactores de agua pesada tienen la ventaja de poder funcionar con uranio natural sin utilizar moderadores de grafito que plantean riesgos radiológicos y de explosión de polvo en la fase de desmantelamiento.
El diseño del RBMK soviético moderado por grafito intentó evitar el uso de uranio enriquecido o agua pesada (en su lugar se refrigeraba con agua «ligera» ordinaria), lo que produjo el coeficiente de vacío positivo que fue uno de los fallos en el diseño del reactor que condujo a la catástrofe de Chernóbil. La mayoría de los reactores modernos utilizan uranio enriquecido y agua ordinaria como moderador.
Otras formas de agua pesada
Agua semipesada
El agua semipesada, HDO, existe siempre que hay agua con hidrógeno ligero (protio, 1H) y deuterio (D o 2H) en la mezcla. Esto se debe a que los átomos de hidrógeno (hidrógeno-1 y deuterio) se intercambian rápidamente entre las moléculas de agua. El agua que contiene un 50% de H y un 50% de D en su hidrógeno contiene en realidad alrededor de un 50% de HDO y un 25% de H2O y D2O, en equilibrio dinámico.
En el agua normal, aproximadamente 1 molécula de cada 3.200 es HDO (un hidrógeno de cada 6.400 está en forma de D), y las moléculas de agua pesada (D2O) sólo se dan en una proporción aproximada de 1 molécula de cada 41 millones (es decir, una de cada 6.4002). Por tanto, las moléculas de agua semipesada son mucho más comunes que las moléculas de agua pesada «pura» (homoisotópica).
Agua con oxigeno pesado
También se comercializa agua enriquecida en los isótopos de oxígeno más pesados 17O y 18O. Se trata de «agua pesada», ya que es más densa que el agua normal (el H218O es aproximadamente tan denso como el D2O, el H217O está a medio camino entre el H2O y el D2O), pero rara vez se denomina agua pesada, ya que no contiene el deuterio que confiere al D2O sus inusuales propiedades nucleares y biológicas. Es más caro que el D2O debido a que la separación de 17O y 18O es más difícil.
El H218O también se utiliza para la producción de flúor-18 para radiofármacos y radiotrazadores y para la tomografía por emisión de positrones. Pequeñas cantidades de 17O y 18O están presentes de forma natural en el agua y la mayoría de los procesos que enriquecen el agua pesada también enriquecen los isótopos más pesados del oxígeno como efecto secundario.
Esto no es deseable si el agua pesada se va a utilizar como moderador de neutrones en reactores nucleares, ya que el 17O puede sufrir una captura de neutrones, seguida de la emisión de una partícula alfa, produciendo 14C radiactivo. Sin embargo, el agua doblemente marcada, que contiene tanto oxígeno pesado como hidrógeno pesado, es útil como trazador isotópico no radiactivo.
Comparado con el cambio isotópico de los átomos de hidrógeno, el cambio isotópico del oxígeno tiene un efecto menor sobre las propiedades físicas.
Agua tritiada
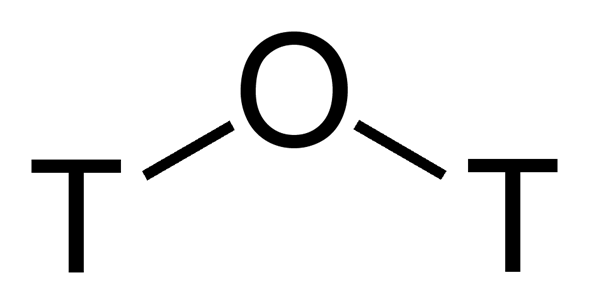
El agua tritiada es una forma radiactiva del agua en la que los átomos habituales de protio se sustituyen por tritio. En su forma pura puede denominarse óxido de tritio (T2O o 3H2O) o agua superpesada. El T2O puro es corrosivo debido a la autorradiolisis. El agua tritiada diluida es principalmente H2O más algo de HTO (3HOH). También se utiliza como trazador para estudios de transporte de agua en la investigación de las ciencias de la vida. Además, como se encuentra de forma natural en cantidades ínfimas, puede utilizarse para determinar la edad de diversos líquidos a base de agua, como los vinos añejos.
El nombre de agua superpesada ayuda a distinguir el material tritiado del agua pesada, que contiene deuterio en su lugar.
El agua tritiada puede utilizarse para medir el volumen total de agua en el cuerpo. El agua tritiada se distribuye en todos los compartimentos corporales con relativa rapidez. Se supone que la concentración de agua tritiada en la orina es similar a la concentración de agua tritiada en el cuerpo. Conociendo la cantidad original de agua tritiada que se ingirió y la concentración, se puede calcular el volumen de agua en el cuerpo.
- Cantidad de agua tritiada (mg) = Concentración de agua tritiada (mg/ml) × Volumen de agua corporal (ml)
- Volumen de agua corporal (ml) = [Cantidad de agua tritiada (mg) – Cantidad excretada (mg)] / Concentración de agua tritiada (mg/ml)
Usos del agua pesada
El óxido de deuterio se utiliza en espectroscopia de resonancia magnética nuclear cuando se utiliza agua como disolvente si el nucleido de interés es el hidrógeno. Esto se debe a que la señal de las moléculas ligeras del disolvente agua (1H2O) interfiere con la señal de la molécula de interés disuelta en ella. El deuterio tiene un momento magnético diferente y, por lo tanto, no contribuye a la señal 1H-NMR en la frecuencia de resonancia del hidrógeno-1.
Para algunos experimentos, puede ser deseable identificar los hidrógenos lábiles en un compuesto, es decir, hidrógenos que pueden intercambiarse fácilmente como iones H+ en algunas posiciones de una molécula. Con la adición de D2O, a veces denominada batido de D2O, los hidrógenos lábiles se intercambian y son sustituidos por átomos de deuterio (2H). Estas posiciones de la molécula no aparecen en el espectro de RMN-1H.
También se utiliza a menudo como fuente de deuterio para preparar isotopólogos específicamente marcados de compuestos orgánicos. Por ejemplo, los enlaces C-H adyacentes a grupos carbonilo cetónicos pueden sustituirse por enlaces C-D, utilizando catálisis ácida o básica.
El yoduro de trimetilsulfoxonio, obtenido a partir de sulfóxido de dimetilo y yoduro de metilo, puede recristalizarse a partir de óxido de deuterio, y luego disociarse para regenerar yoduro de metilo y sulfóxido de dimetilo, ambos etiquetados con deuterio. En los casos en que se contemple el doble etiquetado específico por deuterio y tritio, el investigador debe ser consciente de que el óxido de deuterio, dependiendo de la edad y el origen, puede contener algo de tritio.
A menudo se utiliza óxido de deuterio en lugar de agua cuando se recogen espectros FTIR de proteínas en solución. El H2O crea una banda intensa que se solapa con la región amida I de las proteínas. La banda del D2O se aleja de la región amida I.
Moderador de neutrones
El agua pesada se utiliza en ciertos tipos de reactores nucleares, donde actúa como moderador neutrónico para ralentizar los neutrones de modo que sea más probable que reaccionen con el uranio-235 fisible que con el uranio-238, que captura los neutrones sin fisionarse. El reactor CANDU utiliza este diseño.
El agua ligera también actúa como moderador, pero como el agua ligera absorbe más neutrones que el agua pesada, los reactores que utilizan agua ligera como moderador deben emplear uranio enriquecido en lugar de uranio natural, ya que de lo contrario la criticidad es imposible. Una fracción significativa de reactores de potencia anticuados, como los reactores RBMK de la URSS, se construyeron utilizando agua normal para la refrigeración pero grafito como moderador. Sin embargo, el peligro del grafito en los reactores de potencia (los incendios de grafito provocaron en parte la catástrofe de Chernóbil) ha hecho que se deje de utilizar grafito en los diseños de reactores estándar.
Dado que no requieren enriquecimiento de uranio, los reactores de agua pesada son más preocupantes en lo que respecta a la proliferación nuclear. La obtención y extracción de plutonio puede ser una vía relativamente rápida y barata para construir un arma nuclear, ya que la separación química del plutonio del combustible es más fácil que la separación isotópica del U-235 del uranio natural.
Entre los estados con armas nucleares actuales y pasados, Israel, India y Corea del Norte utilizaron por primera vez plutonio procedente de reactores moderados por agua pesada que quemaban uranio natural, mientras que China, Sudáfrica y Pakistán construyeron por primera vez armas utilizando uranio altamente enriquecido.
El programa nuclear de Alemania en la segunda guerra mundial, que funcionaba con medios más modestos que el contemporáneo Proyecto Manhattan y se vio obstaculizado por el exilio de muchos científicos destacados (muchos de ellos acabaron trabajando para el Proyecto Manhattan), así como por continuas luchas internas, descartó erróneamente el grafito como moderador al no reconocer el efecto de las impurezas.
Dado que la separación isotópica del uranio se consideraba un obstáculo demasiado grande, quedaba el agua pesada como posible moderador. Otros problemas fueron la aversión ideológica hacia lo que la propaganda tachaba de «física judía» y la desconfianza entre los que habían sido miembros del partido nacional socialista entusiastas incluso antes de 1933 y los que eran Mitläufer o intentaban pasar desapercibidos.
En parte debido al sabotaje aliado y a las incursiones de comandos en Norsk Hydro (entonces el mayor productor de agua pesada del mundo), así como a las luchas internas antes mencionadas, el programa nuclear alemán nunca consiguió reunir suficiente uranio y agua pesada en un solo lugar para alcanzar la criticidad a pesar de poseer suficiente de ambos al final de la guerra.
En Estados Unidos, sin embargo, el primer reactor atómico experimental (1942), así como los reactores de producción del Proyecto Manhattan de Hanford que produjeron el plutonio para la prueba Trinity y las bombas Fat Man, utilizaron moderadores neutrónicos de carbono puro (grafito) combinados con tubos de refrigeración de agua normal. No funcionaban ni con uranio enriquecido ni con agua pesada. La producción rusa y británica de plutonio también utilizó reactores moderados por grafito.
No hay pruebas de que se hayan utilizado reactores de potencia civiles de agua pesada -como los diseños CANDU o Atucha- para producir materiales fisibles militares. En los países que aún no poseen armas nucleares, el material nuclear de estas instalaciones está sometido a las salvaguardias del OIEA para desalentar cualquier desvío.
Debido a su posible uso en programas de armamento nuclear, la posesión o importación/exportación de grandes cantidades industriales de agua pesada están sujetas a control gubernamental en varios países. Los proveedores de agua pesada y de tecnología de producción de agua pesada suelen aplicar al agua pesada las salvaguardias y la contabilidad de materiales administradas por el OIEA (Organismo Internacional de Energía Atómica). (En Australia, la Ley de No Proliferación Nuclear (Salvaguardias) de 1987). En EE.UU. y Canadá, cantidades no industriales de agua pesada (es decir, del orden del gramo al kilogramo) están disponibles de forma rutinaria sin licencia especial a través de distribuidores de suministros químicos y empresas comerciales como la antigua gran productora mundial Ontario Hydro.
Para más información Heavy water
Como citar este artículo:
APA: (2023-02-07). Agua pesada. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/agua-pesada/
ACS: . Agua pesada. https://quimicafacil.net/compuesto-de-la-semana/agua-pesada/. Fecha de consulta 2024-10-28.
IEEE: , "Agua pesada," https://quimicafacil.net/compuesto-de-la-semana/agua-pesada/, fecha de consulta 2024-10-28.
Vancouver: . Agua pesada. [Internet]. 2023-02-07 [citado 2024-10-28]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/agua-pesada/.
MLA: . "Agua pesada." https://quimicafacil.net/compuesto-de-la-semana/agua-pesada/. 2023-02-07. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net