Tiempo de lectura estimado: 5 minutos
Características del ácido fluorobórico
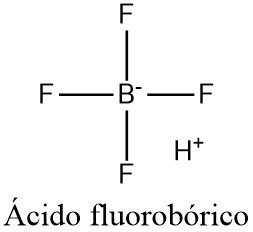
El ácido fluorobórico o ácido tetrafluorobórico (antiguamente llamado ácido fluobórico) es un compuesto inorgánico con la fórmula química [H+][BF4–], donde H+ representa el protón disuelto. El disolvente puede ser cualquier entidad básica de Lewis adecuada. Por ejemplo, en el agua, puede ser representado por H3OBF4 (tetrafluoroborato de oxonio), aunque más realistamente, varias moléculas de agua interactúan con el protón: [H(H2O)n+][BF4–].
El éter etílico como disolvente también está disponible comercialmente: H(Et2O)n+][BF4–], donde n es más probable que sea 2. A diferencia de los ácidos fuertes como el H2SO4 o el HClO4, la sustancia pura no disuelta no existe.
Se produce principalmente como precursor de otras sales de fluoroborato. Como es un ácido fuerte. El ácido fluorobórico es corrosivo y ataca la piel. Está disponible comercialmente como solución en agua y otros solventes como el éter dietílico. Es un ácido fuerte con una base conjugada débilmente coordinada y no oxidante. Es estructuralmente similar al ácido perclórico, pero carece de los peligros asociados a los oxidantes.
Química y síntesis
El ácido fluorobórico puro se ha descrito como un «compuesto inexistente», ya que se espera que un protón suficientemente «desnudo» extraiga un fluoruro del ión tetrafluoroborato para obtener fluoruro de hidrógeno y trifluoruro de boro: [H+][BF4–] → HF + BF3. (Lo mismo ocurre con los superácidos que se conocen por las fórmulas simples HPF6 y HSbF6.)

Sin embargo, una solución de BF3 en HF es altamente ácida, teniendo una especiación aproximada de [H2F+][BF4–] y una función de acidez de Hammett de -16,6 a 7% de BF3, lo que fácilmente califica como superácido. Aunque no se ha aislado el HBF4 libre de disolvente, sus especies en solventes están bien caracterizados. Estas sales consisten en disolvente protonado como catión, por ejemplo, H3O+ y H5O2+, y el anión tetraédrico BF4–. El anión y los cationes están fuertemente ligados al hidrógeno.

Las soluciones acuosas de HBF4 se producen disolviendo ácido bórico en ácido fluorhídrico acuoso. Tres equivalentes del HF reaccionan para dar el trifluoruro de boro intermedio y el cuarto da ácido fluorobórico:

Las soluciones anhidras pueden prepararse mediante el tratamiento del ácido acuoso con anhídrido acético.
La acidez del ácido fluorobórico se complica por el hecho de que el nombre se refiere a varias especies diferentes H(OEt2)+BF4–, H3O+BF4– y HF.BF3, cada una con una acidez diferente. La pKa acuosa se encuentra en literatura como -0,44. La titulación de NBu4+BF4– en solución de acetonitrilo indica que el ácido fluorobórico, es decir, el HF.BF3, tiene una pKa de 1,6 en ese disolvente. Su acidez es, por lo tanto, comparable a la del ácido fluorosulfónico.
Aplicaciones del ácido fluorobórico
El ácido fluorobórico es el principal precursor de las sales de fluoroborato, que suelen prepararse tratando los óxidos metálicos con ácido fluorobórico. Las sales inorgánicas son intermediarias en la fabricación de materiales ignífugos y acabados ceramicos, y en la generación electrolítica de boro. El HBF4 también se utiliza en el grabado del aluminio y en el decapado con ácido.
En química orgánica se utiliza como catalizador para alquilaciones y polimerizaciones. En las reacciones de protección de los carbohidratos, el ácido fluorobórico en eter es un catalizador eficiente y rentable para las reacciones de transaccionalización e isopropilidenación. Las soluciones de este ácido en acetonitrilo cortan los acetales y algunos éteres. Se han obtenido muchos cationes reactivos utilizando ácido fluorobórico, por ejemplo, el tetrafluoroborato de tropilio (C7H7+BF4+), el tetrafluoroborato de trifenilmetilo (Ph3C+BF4+), trietiloxonio tetrafluoroborato (Et3O+BF4–), y el tetrafluoroborato de benceno (PHN2+BF4–).
Las soluciones de HBF4 se utilizan en la galvanoplastia de estaño y aleaciones de estaño. En esta aplicación, el ácido metansulfónico está desplazando el uso del ácido fluorobórico.
Para más información fluoroboric acid
Como citar este artículo:
APA: (2020-09-22). Ácido fluorobórico. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/acido-fluoroborico/
ACS: . Ácido fluorobórico. https://quimicafacil.net/compuesto-de-la-semana/acido-fluoroborico/. Fecha de consulta 2026-03-06.
IEEE: , "Ácido fluorobórico," https://quimicafacil.net/compuesto-de-la-semana/acido-fluoroborico/, fecha de consulta 2026-03-06.
Vancouver: . Ácido fluorobórico. [Internet]. 2020-09-22 [citado 2026-03-06]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/acido-fluoroborico/.
MLA: . "Ácido fluorobórico." https://quimicafacil.net/compuesto-de-la-semana/acido-fluoroborico/. 2020-09-22. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net