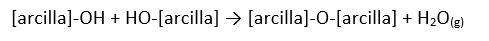Tiempo de lectura estimado: 14 minutos
La cerámica es un material que se fabrica calentando diferente materiales, generalmente un material como el caolín, en un horno a temperaturas de entre 1.200 y 1.400 °C (2.200 y 2.600 °F). La resistencia y la translucidez de la porcelana, en relación con otros tipos de cerámica, se debe principalmente a la vitrificación y a la formación del mineral mullita dentro del cuerpo a estas altas temperaturas.
Aunque las definiciones varían, la cerámica puede dividirse en tres categorías principales: pasta dura, pasta blanda y porcelana de hueso. La categoría a la que pertenece un objeto depende de la composición de la pasta utilizada para hacer el cuerpo del objeto de porcelana y de las condiciones de cocción.
Orígenes de la cerámica
La fabricación de objetos con arcilla quemada forma parte de la experiencia humana desde hace miles de años. Una pequeña figura de mujer es el objeto más antiguo que se conoce hecho de tierra cocida, fechado hace casi 30.000 años. El ejemplo más antiguo conocido de un recipiente de cerámica se hizo hace unos 18.000 años.
Desde entonces, la artesanía de la cerámica se ha desarrollado en todas las partes del mundo, tanto para los fines prácticos de hacer recipientes utilizables para la comida y el almacenamiento, como para expresar el instinto del arte y el ritual. Hace unos 7.000 años, los egipcios descubrieron el arte de vitrificar sus vasijas. Posteriormente, los chinos mejoraron constantemente los hornos y así fue posible producir gres y porcelana cada vez más decorados.
Los inmensos avances en la fabricación de vasijas fueron el resultado del paciente ensayo y error de miles de alfareros a lo largo de miles de años. La aproximación científica al proceso sólo fue posible en los dos últimos siglos, inicialmente al establecer las composiciones de los materiales utilizados.
Más recientemente, con el desarrollo de las técnicas analíticas modernas, ha sido posible dilucidar sus estructuras. Aunque ahora se sabe mucho sobre los materiales y sus estructuras, hay tantas variables y las estructuras son tan complejas, que el enfoque empírico sigue dominando en gran medida la fabricación de recipientes cerámicos.
Haciendo una cerámica
Hay muchas maneras de hacer un recipiente de cerámica. La construcción a mano es el método más antiguo y todavía se utiliza mucho. El torno de alfarero se inventó hace unos 7000 años y se ha convertido en el método preferido por muchos alfareros.
En todos los métodos es esencial que la arcilla contenga algo de agua; no demasiada, porque eso hace que la arcilla sea demasiado blanda y no se pueda trabajar, o incluso la convierte en «engobe», una dispersión de arcilla en agua. La esencia de la plasticidad es que la arcilla adopta la forma que se le da al aplicar una fuerza y mantiene esa forma a menos que otra fuerza actúe sobre ella.
Esta propiedad se entiende fácilmente si consideramos que las capas están separadas por una fina capa de moléculas de agua que están unidas a las capas vecinas mediante enlaces de hidrógeno. Se trata de fuerzas débiles pero significativas. Son lo suficientemente débiles como para permitir que las láminas de arcilla se deslicen entre sí cuando se aplica alguna fuerza, pero lo suficientemente fuertes como para mantenerlas en su posición una vez que se retira la fuerza. En otras palabras, la arcilla puede ser moldeada en una forma, que luego mantiene.
Cuando la arcilla se seca, las moléculas de agua se escapan de entre las láminas de arcilla, por lo que éstas se acercan entre sí (la arcilla se encoge un 5% o más). Los hidroxilos de caolinita se unen con hidrógeno a la siguiente capa, formando una estructura más fuerte y firme («cerámica cruda»). Si en este punto el objeto de arcilla se introduce en el agua, se desintegra y puede volver a ser maleable.
La arcilla
Los minerales del grupo de los feldespatos constituyen alrededor del 60% de la corteza terrestre. Son silicatos de aluminio, que también incorporan metales alcalinos y/o alcalinotérreos. Un ejemplo típico es la ortoclasa, cuya composición aproximada es K2O.Al2O3.6SiO2. A lo largo de la escala de tiempo geológica, una gran cantidad de feldespato se ha erosionado mediante un proceso de meteorización, principalmente por la acción del agua.
Aunque estas rocas parecen sólidas y eternas, a lo largo de millones de años el efecto de la lluvia, ligeramente ácida por el CO2 disuelto, disuelve algunos de los óxidos de metales alcalinos y alcalinotérreos dejando los óxidos de silicio y aluminio:
La arcilla se encuentra en el lugar donde se ha formado o puede ser transportada por los ríos y depositada en otro lugar. Cuando es transportada por el agua, las partículas siguen siendo molidas cada vez más finas por la acción de otras rocas. También se separan por tamaño según lo que se deposita primero. Como resultado, la arcilla es un componente principal del suelo en todo el mundo, con una variedad de propiedades según las condiciones precisas que se aplicaron durante su formación.
Estructuras cristalinas
Los estudios cristalográficos han establecido que los minerales de arcilla están compuestos por láminas de dióxido de silicio tetraédrico (SiO2) y de óxido de aluminio octaédrico (Al2O3) enlazadas a través de átomos de oxígeno de puente. En la superficie de óxido de aluminio de las «láminas» algunos de los oxígenos están en forma de grupos OH y también hay grupos OH dentro de la estructura. A grandes rasgos, hay dos categorías principales de minerales de arcilla: los que tienen una hoja de óxido de silicio y otra de óxido de aluminio y los que tienen dos hojas de óxido de silicio que encierran una hoja de óxido de aluminio.
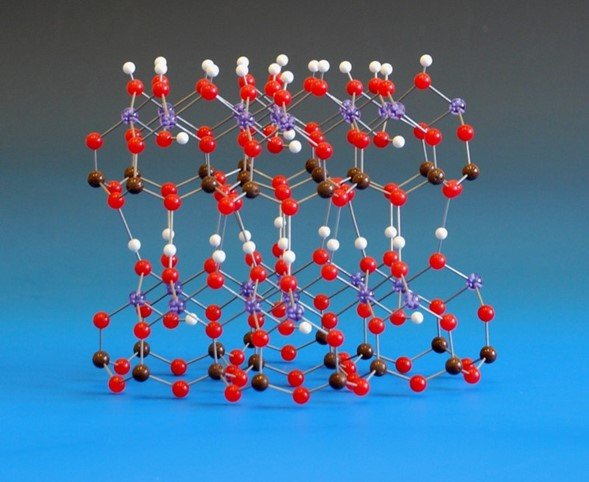

El mineral más importante de la cerámica es la caolinita, que contiene una proporción de 1:1 de óxidos de silicio y aluminio. La estructura cristalina muestra partículas en forma de placa, que se apilan en capas unidas por enlaces de hidrógeno. A través de la estructura, las propiedades y las transformaciones de la caolinita podemos entender los cambios físicos que se producen en la fabricación de una vasija.
Aunque existen yacimientos de caolinita prácticamente pura, en la práctica siempre se utiliza como parte de una mezcla con otros minerales, ya sea porque se extrae del suelo en estado impuro y se utiliza directamente o porque se mezcla con otros minerales (por ejemplo, feldespato y cuarzo) para conseguir las propiedades deseadas.
Calentando la cerámica
A continuación, se calienta la olla seca para expulsar algo más de agua. Una vez que la temperatura de la vasija alcanza los 500ºC, los cambios en ella son irreversibles. En este punto, la arcilla es muy frágil y desmenuzable, pero ya no puede reconstituirse en su estado original. Esta etapa se describe como la expulsión del llamado agua químicamente ligada:
Los débiles enlaces de hidrógeno se sustituyen por puentes de oxígeno más fuertes y cortos (la arcilla puede encogerse un poco más). Cuando esto ocurre, la arcilla ya no puede reutilizarse. La unión de las partículas de arcilla vecinas es un proceso gradual y, si se detiene la cocción a unos 500ºC, se formarán suficientes enlaces cruzados para impedir el reformado, pero no los suficientes para fortalecer la pieza. Al mismo tiempo, se pierde la estructura cristalina regular en forma de lámina de la caolinita y se forma la metacaolinita amorfa.
Por lo general, la vasija se cuece primero a unos 1.000°C para producir lo que se conoce como «cerámica de galleta» con una ligera contracción posterior. La cerámica de galleta o gres es bastante fuerte y porosa; absorbe fácilmente el agua y se vuelve a secar con mucha facilidad. Se esmalta extendiendo una suspensión de sólidos de esmalte en agua sobre la vasija mediante vertido, inmersión o pulverización y, cuando está seca, se vuelve a cocer a la temperatura adecuada para la arcilla y el esmalte.
Gres y loza
Durante la cocción se producen otros cambios químicos. Estos incluyen la quema de toda la materia orgánica que suele encontrarse en muchas arcillas, la descomposición de los carbonatos, que son ingredientes comunes de muchos esmaltes, y la posterior reticulación de la metacaolinita para dar lugar a una red tridimensional con la eliminación del agua. Este proceso no llega a completarse hasta las temperaturas de la loza, pero a las temperaturas del gres desaparece toda el agua. Es difícil de creer que el agua esté presente en las ollas cocidas a temperaturas de loza, pero es fácil de demostrar:
Tome dos tazas, una de loza y otra de gres, y ponga agua en ambas. Introdúzcalas en un microondas y póngalo a máxima potencia durante 2 o 3 minutos. El agua en ambas debe estar caliente; el asa de la taza de loza también estará caliente, mientras que la de la taza de gres estará fría. Dado que los hornos microondas calientan el agua haciendo que las moléculas de agua se muevan más rápido, el asa caliente de la taza de loza indica la presencia de moléculas de agua libres y móviles.
A la temperatura del gres, la metacaolinita se transforma en mullita (3Al2O3.2SiO2) que forma cristales en forma de aguja, mientras que el feldespato presente se funde en un vidrio, uniendo los cristales de mullita. Estos dos cambios estructurales explican la mayor dureza y resistencia del gres respecto a la loza.
Esmaltes en la cerámica
La mayoría de las vasijas están esmaltadas, es decir, cubiertas por una fina capa de vidrio. Esto puede ser por razones estéticas o prácticas, normalmente ambas. Es especialmente importante para los recipientes que contienen alimentos. El esmalte suele tener tres componentes principales:
- dióxido de silicio para proporcionar el cuerpo principal
- óxido de aluminio para aumentar la viscosidad del esmalte mediante la reticulación de las redes de sílice
- fundentes, generalmente óxidos de metales alcalinos o alcalinotérreos, para reducir el punto de fusión de la mezcla a la temperatura de cocción.
Además, es habitual incluir óxidos de metales de transición para dar color al esmalte.
El alfarero debe tener en cuenta tres propiedades importantes de un esmalte. Son la textura (rugosa o lisa), la opacidad (transparente u opaca) y el color. La mejor manera de considerar las dos primeras es en función de las propiedades de fusión de las mezclas sólidas.
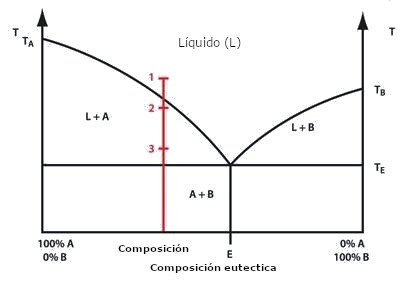
Un diagrama de fases generalizado (Fig. 1) ilustra esta cuestión. Consideremos una mezcla de composición indicada por la línea roja; cuando alcanza la temperatura TE, comienza a fundirse. A medida que la temperatura aumenta, la proporción de sólido disminuye y la de líquido aumenta hasta que el último sólido se funde.
El punto «1» corresponde a un esmalte totalmente fundido a la temperatura de maduración. Este tipo de esmalte se utiliza cuando se ha realizado toda la decoración antes del esmaltado y si se requiere una superficie lisa y brillante.
El punto «2» marca la temperatura de maduración cuando se requiere un esmalte opaco; éste debe tener una superficie lisa (el esmalte es principalmente líquido), pero debe incluir algún sólido para dispersar la luz y proporcionar la opacidad. En la práctica, la temperatura de un horno puede variar considerablemente del valor nominal, lo que puede complicar las cosas; la figura 2 lo ilustra bien.
La copa mostrada se hizo para que tuviera manchas opacas en relieve, pero se colocó demasiado cerca de los elementos calefactores, por lo que el rango de temperatura experimentado por la copa se situó cerca de la línea de líquido. Las manchas de la derecha de la imagen estaban a «1» y las de la izquierda a «2», como se pretendía.
La temperatura indicada en el punto «3» produce un esmalte que sigue siendo principalmente sólido con sólo una pequeña parte fundida. Este tipo de esmaltes son ásperos al tacto, ya que el líquido sólo es suficiente para que los componentes sólidos se adhieran entre sí y al objeto; no se recomienda su uso con alimentos.
Aunque el diagrama de fases ilustra el fenómeno general, representa una simplificación excesiva de la situación real de los esmaltes por dos razones principales. Una de ellas es que la mayoría de los esmaltes están formados por más de dos componentes, y la otra es que el diagrama presupone que no se producen cambios químicos hacia o entre A y B. Esto casi nunca ocurre, por lo que cualquier diagrama de fases que represente el comportamiento de un esmalte real sería mucho más complicado.
Color
Los principales minerales que componen los esmaltes son incoloros. Tanto el SiO2 (cuarzo) como el Al2O3 (corindón) se conocen en la naturaleza en estado puro como sólidos cristalinos blancos. También se encuentran en formas contaminadas: la amatista y el citrino son cuarzos contaminados con hierro, y el rubí es corindón contaminado con cromo. Cuando los contaminantes del corindón son Fe, Co, Ti y V se conocen como zafiros de varios colores.
En la mayoría de los esmaltes, el color lo aportan los óxidos de los metales de transición de la primera fila; además de los ya mencionados, también se utiliza mucho el cobre. En cerámica, los óxidos colorantes más comunes son los de hierro, cobre y cobalto. De ellos, el hierro parece ser el más versátil; dependiendo de las condiciones de cocción y de lo que haya en el esmalte, puede dar lugar a rojos, amarillos, marrones, azules y verdes en varias tonalidades.
Como es lógico, las dos variables dominantes son el estado de oxidación y el entorno del ion del metal de transición. Los alfareros que utilizan hornos calentados por madera, gas o aceite, tienen la opción de utilizar condiciones reductoras durante parte de la cocción. El suministro de oxígeno está restringido y la atmósfera del horno se vuelve rica en monóxido de carbono.
Si los metales de transición están presentes en baja concentración en el esmalte, pueden reducirse a un estado de oxidación inferior. La taza (fig. 3) con esmalte de hierro se coció en condiciones reductoras. El esmalte del interior contiene un 0,5% de óxido de hierro (III) y el del exterior un 10%; el poder reductor del CO fue suficiente para convertir el hierro del esmalte interior en Fe (II), pero la concentración de hierro en el esmalte exterior era demasiado elevada.
La vasija (fig. 4) está vidriada con una mezcla que contiene CuO. En condiciones de oxidación aparece en el conocido azul o verde de los compuestos de cobre. En condiciones de reducción, el cobre está presente como una mezcla de Cu2O y cobre elemental finamente disperso, de ahí el color observado.
Lo fascinante de la cerámica es que las variables son muchas, las posibilidades son infinitas y ofrece oportunidades para la creatividad tanto artística como científica.
Para más información The chemistry of pottery
Como citar este artículo:
APA: (2021-04-29). La química de la cerámica. Recuperado de https://quimicafacil.net/notas-de-quimica/la-quimica-de-la-ceramica/
ACS: . La química de la cerámica. https://quimicafacil.net/notas-de-quimica/la-quimica-de-la-ceramica/. Fecha de consulta 2026-02-13.
IEEE: , "La química de la cerámica," https://quimicafacil.net/notas-de-quimica/la-quimica-de-la-ceramica/, fecha de consulta 2026-02-13.
Vancouver: . La química de la cerámica. [Internet]. 2021-04-29 [citado 2026-02-13]. Disponible en: https://quimicafacil.net/notas-de-quimica/la-quimica-de-la-ceramica/.
MLA: . "La química de la cerámica." https://quimicafacil.net/notas-de-quimica/la-quimica-de-la-ceramica/. 2021-04-29. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net