Tiempo de lectura estimado: 16 minutos
- La cerveza y el pH
- Primeras definiciones de acidez
- Origen del término pH
- Errores de proteína
- Respuesta matemática
- Capacidad de medición de pH
- Consideraciones teóricas y prácticas
- Celda de Harned
- Modelo Debye-Hückel y la estandarización del pH
- Electrodos de pH
- Electrodos combinados
- Importancia del pH en la vida y en la ciencia
Los laboratorios industriales, aunque su objetivo es hacer avanzar los procesos industriales prácticos, también pueden ser la cuna de conceptos teóricos. Tal fue el caso del concepto de pH, introducido en 1909 por Søren Sørensen como una forma cómoda de expresar la acidez: el logaritmo negativo de la concentración de iones de hidrógeno.
La cerveza y el pH
La elaboración de cerveza y la ciencia, especialmente la química, han estado entrelazadas a lo largo de la historia. De hecho, la búsqueda de una mejor cerveza y de mejores métodos para elaborarla ha llevado a muchos avances científicos. Uno de los más importantes desde la perspectiva de la química fue la introducción del concepto de pH por parte de Søren Peter Lauritz Sørensen, una cantidad que mide la acidez y la basicidad.
En 1909, Sørensen (1868-1939), un bioquímico danés y director de los laboratorios de investigación de las cervecerías Carlsberg en Copenhague, desarrolló una escala numérica de pH como una forma sencilla de expresar las concentraciones de iones de hidrógeno, que había descubierto que desempeñaban un papel clave en las reacciones enzimáticas.
En la actualidad, la mayoría de las cosas que usamos a diario, como el agua del grifo, los alimentos y bebidas, los cosméticos y los medicamentos, se prueban para determinar su pH. Y, por supuesto, muchos procesos químicos y bioquímicos dependen del pH.
Primeras definiciones de acidez
En 1884, Svante Arrhenius (1859-1927) afirmó su Teoría de Disociación Electrolítica y produjo la primera definición de un ácido basada en su composición química y en su capacidad de disociarse en solución acuosa con la producción de iones de hidrógeno, H+.
Por primera vez, se consideró que una base era una sustancia que se disociaba en agua en iones hidroxilo, OH–, y no simplemente una sustancia que se oponía a los efectos de un ácido. La concentración de iones de hidrógeno (cH) puede abarcar varios órdenes de magnitud, desde valores relativamente altos (por ejemplo, por encima de 1 mol dm-3 [= 100 mol dm-3]), como es el caso de soluciones concentradas de ácidos minerales fuertes, hasta valores bajos expresados en términos de potencias de 10 con un exponente negativo (por ejemplo, 10-12 mol dm-3 para soluciones concentradas de bases fuertes).
Origen del término pH
Incluso antes de definir el pH, Sørensen había llevado a cabo investigaciones pioneras sobre la síntesis de aminoácidos, la preparación de soluciones amortiguadoras de referencia y la evaluación colorimétrica de la acidez. Por razones prácticas, Sørensen definió pcH como el logaritmo negativo de las concentraciones de iones de hidrógeno. Este exponente negativo, cH = 10-pcH, es numéricamente igual al logaritmo en base 10 de la concentración de iones de hidrógeno, pcH = -lg cH = -lg 10-pcH. La elección de «pH» fue simplemente porque representaba pondus Hydrogenii, aunque en otros idiomas podría representar potencia, potenz, potence, etc.
La mayoría de las veces, los valores de concentración se encuentran entre 1 mol dm-3 y 10-14 mol dm-3, con valores de pH definidos de 0 y 14, respectivamente. Sin embargo, y a pesar de la idea errónea relativamente común de que solo hay valores de pH por encima de 0, se pueden encontrar valores de pH negativos en la naturaleza (por ejemplo, en aguas de minas extremadamente ácidas).
Errores de proteína
Mientras realizaba investigaciones sobre el efecto de las concentraciones de iones en el análisis de proteínas, Sørensen notó un cambio de color de algunos indicadores ácido-base, producido en presencia de proteínas, lo que sugiere un cambio de pH, generalmente hacia valores más alcalinos. Este «error de proteína» permite la detección de proteínas mediante tiras de papel impregnadas con indicador tamponado: con pH constante, el indicador presenta un color en ausencia de proteínas y otro diferente en su presencia.
Por esta razón y porque muchos procesos fisiológicos dependen del pH, no es sorprendente que el primer artículo de revisión sobre pH, publicado por L. Michaelis, mencionara la importancia de la concentración de iones de hidrógeno y su medición para la biología.
Respuesta matemática
Tener una definición conceptual de pH es una cosa, pero tener una realización experimental de la cantidad definida y la asignación de un valor de pH a una cierta solución es otra cuestión. Como descubrieron Sørensen y otros, la detección colorimétrica con indicadores de color no permite una sensibilidad a los cambios de pH mejor que 0,5, lo que hace que el método sea inadecuado para objetivos químicos exigentes.
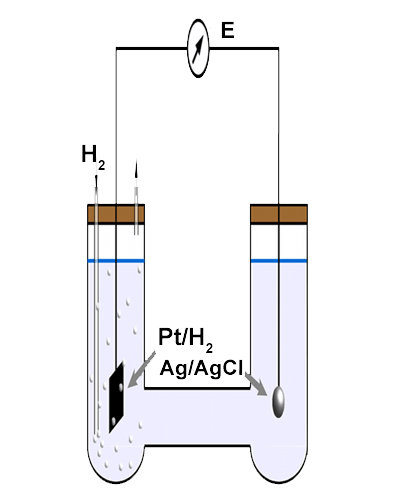
Junto con su definición, Sørensen propuso un procedimiento electrométrico para la evaluación del pH basado en la medición del potencial, EH+/H2, del electrodo de gas de hidrógeno basado en platino, Pt,H2, (o basado en paladio, Pd,H2), sensible a los iones de hidrógeno H+ que había sido desarrollado por LeBlanc. Una lámina delgada de platino recubierta electrolíticamente con un depósito finamente dividido de metal de platino o paladio, en soluciones saturadas con gas de hidrógeno, cataliza la reacción del electrodo:
Esta reacción del electrodo permite la medición de la diferencia de potencial entre el electrodo de hidrógeno y un electrodo de referencia, como el electrodo de calomel, que generalmente se establece en un potencial de 0.00 V a 25 °C. La diferencia de potencial entre los dos electrodos puede relacionarse con el pH de la solución que se está midiendo a través de la ecuación de Nernst:
donde es el potencial del electrodo de hidrógeno estándar (0.00 V), R es la constante de los gases, T es la temperatura, F es la constante de Faraday y H+ es la concentración de iones de hidrógeno.
El procedimiento electrométrico basado en el electrodo de hidrógeno permite una precisión y exactitud mucho mayores en las mediciones de pH que los métodos colorimétricos, y se ha convertido en el método estándar para la medición de pH en muchos campos de la ciencia y la industria.
Este electrodo de gas de hidrógeno basado en Pt (o Pd) es universalmente aceptado como el estándar primario, SHE, con el cual se comparan todos los demás electrodos. Esto se debe a que cumple con los requisitos de reversibilidad y reproducibilidad para un punto de referencia arbitrario de una escala numérica de potenciales en medios acuosos , a todas las temperaturas y para condiciones estándar de presión de gas de hidrógeno y composición de iones de hidrógeno).
En la práctica, no se puede evaluar independientemente el potencial de un solo electrodo y solo se pueden calcular las diferencias de potencial entre dos electrodos. Sørensen propuso que el pH de una solución desconocida (X) se obtiene a partir del potencial, E (medido en condiciones potenciométricas; es decir, corriente nula) de una celda previamente desarrollada por Bjerrum, representada a continuación en términos de notación convencional:
La celda se forma combinando dos semiceldas, una que contiene el electrodo de gas de hidrógeno basado en platino (Pt,H2), interfazando con una solución que contiene iones de hidrógeno, y la otra basada en un electrodo de calomel (Hg,Hg2Cl2) sensible a los iones de cloruro (Cl–) presentes en la solución con la que se interconecta, introducido por Ostwald. Un puente salino establece el contacto electrolítico entre las soluciones de las dos semiceldas.
Como ley analítica se utilizó la ecuación empírica de Nernst:
E1 y E2 son los potenciales celulares a concentraciones (cH)1 y (cH)2, respectivamente. R es la constante de los gases, F es la constante de Faraday y T es la temperatura absoluta. Existe una relación lineal entre el potencial, E, y el pH; la pendiente de la recta, RT ln 10/F (cambio de potencial cuando la concentración cambia diez veces), es conocida como la pendiente de Nernst, igual a 59,16 mV a 25 °C.
Capacidad de medición de pH
Las leyes analíticas que relacionan la señal medida con la concentración del analito previsto, específicamente la ecuación de Nernst teórica para el ion hidrógeno, son estrictamente observadas en sistemas ideales. Por lo tanto, en términos prácticos, es probable que se produzcan desviaciones debido a las interacciones entre las especies presentes en los sistemas.
Con el desarrollo de la termodinámica de Gibbs y el concepto de actividad de una especie química, αi, introducido por Lewis, se hizo evidente que las leyes analíticas que relacionan una señal medida con la concentración del analito previsto son estrictamente observadas en sistemas ideales. Ambas cantidades, actividad y concentración, están relacionadas a través de un factor de conversión, el coeficiente de actividad, γi, que depende de la concentración y de la matriz.
Las mediciones potenciométricas son capaces de suministrar coeficientes de actividad a partir de ciertos experimentos bien definidos; en casos en los que se conoce la concentración, las comparaciones entre el potencial de Nernst calculado y medido se han utilizado para evaluar los coeficientes de actividad. Sørensen redefinió el pH como pH = -lg aH.
La nueva formulación de la ecuación de Nernst y la conciencia de la contribución de los potenciales de unión líquido-líquido desconocidos llevaron a Sørensen y K. Linderstrøm-Lang a reconocer que el procedimiento experimental propuesto no conduce a pH= -lg cH, ni a pH= -lg aH, sino a alguna otra cantidad, denominada psH, que, aunque simplemente conveniente, fue ampliamente aceptada por la comunidad científica.
Consideraciones teóricas y prácticas
Con el electrodo de hidrógeno sumergido en 1 mol dm-3 de HCl, con H2 burbujeando a 1 atm y 18°C, Sørensen informó de un potencial de celda de 0,338 V contra el cual un gran número de soluciones tampón tuvieron sus valores de psH asignados a partir del potencial correspondiente medido, E.
El concepto de pH corresponde únicamente a una definición teórica y es único en el sentido de que implica una única cantidad iónica, la actividad del ion hidrógeno, que no existe por sí sola y, por lo tanto, no es medible por ningún método termodinámicamente válido. Su evaluación requiere convenciones extra-termodinámicas.
Celda de Harned
El procedimiento convencionalmente adoptado para asignar valores de pH primario estándar (pH[PS]) a soluciones tampón de pH estándar primario (PS) se basa en la celda sin transferencia, conocida como celda de Harned:
La celda está compuesta por el electrodo de gas de hidrógeno basado en platino (o basado en paladio) y el electrodo de plata-cloruro de plata, sumergidos en la solución tampón de referencia en estudio con cloruro de potasio añadido (mKCl= 0,005; 0,01; 0,015 mol kg-1) para garantizar las condiciones de trabajo adecuadas del electrodo de plata-cloruro de plata.
Fue desarrollada por R.G. Bates y colaboradores en la Oficina Nacional de Normas de los Estados Unidos (luego cambiada al Instituto Nacional de Normas y Tecnología). Ha sido ligeramente modificada por institutos metrológicos nacionales en todo el mundo para cumplir con los requisitos de un método primario.
Aplicando de la ecuación de Nernst a la reacción espontánea en la celda
La ecuación de la célula potencial, E, es el punto de partida de un procedimiento convencional que, en un paso intermedio, define una función de acidez, p(ɑH γCl), en términos de cantidades experimentalmente accesibles que aún están libres de suposiciones. Esta es la razón por la cual a menudo se informa y se utiliza en estudios comparativos.
Modelo Debye-Hückel y la estandarización del pH
La adopción del modelo de Debye-Hückel de interacción iónica en soluciones electrolíticas condujo a la asignación final del valor de pH convencional. Esto fue posible gracias a la introducción de la convención Bates-Guggenheim para el coeficiente de actividad del ion cloruro, con una incertidumbre asignada de 0,01 en pH. Los coeficientes de actividad, γi, también se pueden calcular mediante la teoría de Pitzer, en la que se tienen en cuenta las interacciones iónicas específicas que permiten el cálculo de valores de pH y cantidades relacionadas para medios más complejos.
La interpretación cuantitativa de los valores de pH medidos se limita a soluciones acuosas diluidas de solutos simples. Este requisito presenta limitaciones para los medios no acuosos, suspensiones, coloides y soluciones acuosas de fuerza iónica mayor a 0,1 mol kg-1, para los cuales son necesarias consideraciones adicionales. La definición de este procedimiento como el método primario de medición ha permitido la designación de un conjunto de siete soluciones estándar primarias para pH, pH(PS), entre aquellas con la «mayor calidad metrológica».
El método potenciométrico utilizando el electrodo de gas de hidrógeno basado en Pt (o Pd) es el método para la asignación de valores de pH aceptado por la investigación y el trabajo de laboratorio que requiere mediciones precisas y exactas de pH (excepto en aquellos casos en los que la presencia de ciertas clases de sustancias en la solución interfiere con la medición del potencial del electrodo de gas de hidrógeno). A pesar de los méritos del electrodo de gas de hidrógeno, ciertamente no es práctico para mediciones de rutina. El descubrimiento de Cremer en 1906 de la selectividad del electrodo de vidrio confiable y accesible hacia el H+ fue un hito significativo para la medición práctica del pH.
Electrodos de pH
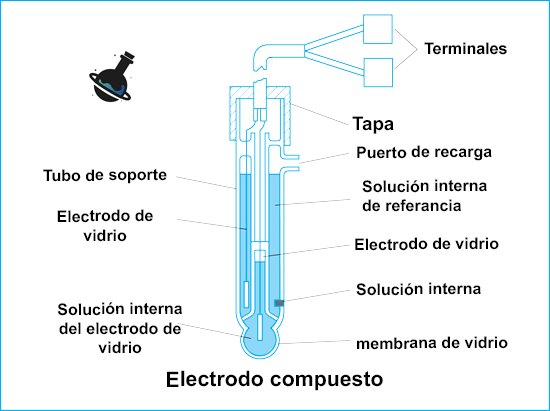
Un electrodo de vidrio generalmente se fabrica sellando una ampolla de vidrio de sílice de aproximadamente 0,2 mm de espesor que contiene óxidos metálicos que rompen la estructura del vidrio en algunos puntos, y luego fusionándola a un vástago de vidrio eléctricamente aislante. Durante muchos años, el vidrio más sensible al H+ disponible estaba compuesto por Na2O (21,4% mol), CaO (6,4%) y SiO2 (72,2%), conocido como vidrio Corning 015, cuyo potencial seguía la ecuación de Nernst entre pH 1 y 9.
Se han introducido varios cambios en la composición del vidrio para mejorar las propiedades deseables del electrodo de vidrio, pero ningún electrodo de vidrio construido hasta ahora tiene la respuesta teórica en todos los tipos de soluciones y en todo el rango práctico de pH.
Al remojar la ampolla de vidrio en agua, se produce una mayor ruptura de la estructura y los espacios abiertos se llenan de moléculas de agua de la solución, lo que produce una hinchazón observable. Se crea una capa de gel con iones de hidrógeno, que establece una diferencia de potencial a través de la frontera vidrio-solución, desarrollando así una función de hidrógeno del vidrio.
Se han desarrollado otros sensores de iones de hidrógeno, pero ninguno supera al electrodo de vidrio, como se demostró en los estudios comparativos de Hughes entre los electrodos de vidrio y de gas de hidrógeno. Ocurren desviaciones tanto en la región ácida como en la región alcalina, que son consecuencia de la selectividad hacia los cationes alcalinos y alcalino-térreos.
La ampolla de vidrio tiene dos superficies. La superficie exterior está en contacto con la solución cuyo pH se va a medir. La superficie interior se mantiene en contacto con una solución de pH constante, 0,1 mol dm-3 de HCl, en la que se sumerge un electrodo interno de plata-cloruro de plata, que proporciona una conexión eléctrica y un potencial estable durante las mediciones. Las mediciones de potenciales de celda también requieren un electrodo de referencia externo, generalmente de plata-cloruro de plata, Ag,AgCl.
Electrodos combinados
Los electrodos combinados en los que el electrodo de vidrio y el electrodo de referencia externo se ensamblan juntos están disponibles comercialmente y se utilizan ampliamente. Debido a la alta resistencia eléctrica del vidrio, del orden de MΩ, las mediciones de potenciales requieren un elemento detector que opere con una corriente muy pequeña que dependa del desarrollo de amplificadores de corriente. El primer medidor de pH electrónico comercialmente exitoso fue inventado por Beckman. Esto sentó las bases para la determinación potenciométrica del pH mediante electrodos combinados de vidrio y medidores de pH de microprocesadores actualmente en uso.
Las mediciones prácticas del pH suelen utilizar estas celdas de trabajo con uniones líquidas que son prácticas, pero tienen mayores incertidumbres asociadas a los resultados.
Para utilizar un electrodo de vidrio para medir el pH de soluciones desconocidas se requiere una calibración previa. Esto se hace mediante la medición previa del potencial de celda de trabajo en soluciones tampón estándar de pH conocido, como los típicos de NBS/NIST, o otros específicamente recomendados para las características particulares de la muestra (por ejemplo, fluidos fisiológicos y agua de mar).
El enfoque jerárquico de las mediciones facilita las calibraciones de laboratorio para lograr incertidumbres objetivo especificadas que sean autónomas dentro de los presupuestos de incertidumbre. De esta manera, y a pesar de la definición convencional de pH, los valores se volverán rastreables al sistema SI aceptado internacionalmente. Este es un problema difícil de resolver que la comunidad científica ha tenido dificultades para resolver.
Importancia del pH en la vida y en la ciencia
Los procesos químicos y bioquímicos cotidianos se controlan mediante mediciones de pH. Es probablemente el parámetro químico más medido y el que más personas escuchan o hablan. El hecho de que los medidores de pH estén ampliamente disponibles a un costo relativamente bajo y que las mediciones sean bastante sencillas, incluso para aquellos sin capacitación profesional, ha resultado en la idea equivocada de que todo lo relacionado con el pH es conocido y claro. De hecho, más allá del simple proceso de medición de pH, hay una comprensión deficiente del concepto, la base de su derivación y las limitaciones de su aplicabilidad. A pesar de las diversas limitaciones fundamentales, las mediciones potenciométricas de pH son populares, fáciles, sensibles, confiables, importantes y útiles, y seguirán siendo realizadas. Los enfoques educativos sobre este tema deben mejorarse, especialmente a nivel escolar introductorio.
Para más información One-Hundred Years of pH
Como citar este artículo:
APA: (2023-08-24). Historia del pH. Recuperado de https://quimicafacil.net/notas-de-quimica/historia-del-ph/
ACS: . Historia del pH. https://quimicafacil.net/notas-de-quimica/historia-del-ph/. Fecha de consulta 2026-03-03.
IEEE: , "Historia del pH," https://quimicafacil.net/notas-de-quimica/historia-del-ph/, fecha de consulta 2026-03-03.
Vancouver: . Historia del pH. [Internet]. 2023-08-24 [citado 2026-03-03]. Disponible en: https://quimicafacil.net/notas-de-quimica/historia-del-ph/.
MLA: . "Historia del pH." https://quimicafacil.net/notas-de-quimica/historia-del-ph/. 2023-08-24. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net