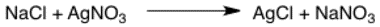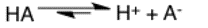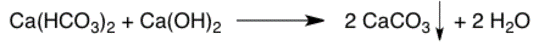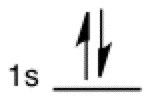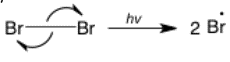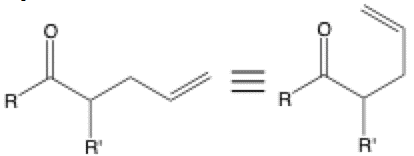Tiempo de lectura estimado: 15 minutos
La química ya es lo suficientemente confusa con los procedimientos de nomenclatura de la IUPAC para conocer, y la diferencia entre las descripciones de alquenos E/Z y cis/trans, y tantos otros nuevos términos, modelos, unidades y símbolos. Pero el símbolo más común e importante en química es la flecha.
En la mayoría de los textos no se explica a profundidad el significado y uso adecuado de las flechas en las diferentes ramas de la química, lo que dificulta la comprensión de textos y esquemas de reacción, al igual que impide la comunicación científica a través de informes de ensayos y prácticas.
¿Por qué son importantes las flechas en química?
Conocer las convenciones de las flechas en química es importante para comunicar el significado de una manera universalmente entendida.
En el ámbito académico, se emplean símbolos estandarizados para evaluar y retroalimentar el desempeño de los estudiantes en sus tareas. En el presente caso, se han asignado significados específicos a los símbolos ✓ y ✕. Mientras que el primero indica respuestas correctas, el segundo denota respuestas incorrectas. Este enfoque se aplica para facilitar la comprensión de los resultados y para fomentar la mejora continua.
Es igualmente relevante destacar que, en el contexto de la química, las flechas correctas tienen un papel esencial en la presentación adecuada de reacciones y conceptos. Al utilizar las flechas apropiadas, se promueve la claridad y se evita la confusión.
Para favorecer el reconocimiento y uso preciso de estos símbolos, se ha elaborado una guía detallada de las flechas más comunes en química. Asimismo, se ha organizado dicha guía considerando el nivel de estudio en el que se encuentre el estudiante.
Espero que esta información te sea de utilidad y te ayude a mejorar tus habilidades en el campo de la química. Si tienes alguna duda o inquietud, no dudes en consultarla. ¡Sigue adelante con tu aprendizaje! ✓
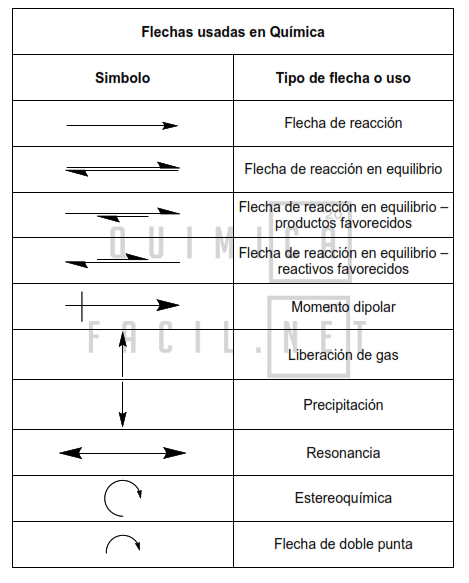
Tabla de flechas comunes en química
A continuación, encontraras una tabla con las flechas comúnmente usadas en las diversas ramas de la química. También puedes descargarla en formato PDF para su impresión.

Flechas en Química general e inorgánica
Flecha de reacción
Esta es la flecha más básica que muestra los reactivos a la izquierda y los productos a la derecha.
La conversión de un reactivo a un producto se muestra comúnmente con una flecha de reacción química. La mayoría de las reacciones fundamentales en química (adición, sustitución, desplazamiento, descomposición, etc.) se expresan en una ecuación química utilizando esta flecha de reacción.
La cola de la flecha se encuentra hacia el sustrato. La cabeza apunta a los productos, lo que implica que la reacción siempre procede a la generación de productos. Por lo tanto, la flecha también se llama flecha hacia adelante, ya que muestra la dirección en la que procede la reacción química.
Los reactivos y los catalizadores se escriben encima de la flecha, mientras que las condiciones de reacción (tiempo, temperatura, solvente) se encuentran debajo.
Si la formación de un producto involucra más de una reacción, en ese caso se puede utilizar una sola flecha de reacción para denotar todos los pasos necesarios. Las reacciones subsiguientes se numeran, mencionando los reactivos y las condiciones de reacción. Se escriben arriba o debajo de la flecha de reacción química.
Flecha de reacción de equilibrio
Las flechas de equilibrio significan que la reacción es reversible. En el ejemplo proporcionado de un equilibrio ácido-base general, el ácido ganará y perderá protones en solución. Esto no significa que la velocidad de las reacciones en cualquier dirección sea cero; simplemente significa que son iguales y opuestas.
En una reacción reversible con velocidades similares, la reacción hacia adelante y la reacción inversa conducen a un equilibrio, un estado de la reacción química que no llega a completarse. Por lo tanto, un tiempo de reacción más prolongado no provoca ningún progreso significativo y no conduce a ningún cambio en la concentración de los reactivos o productos.
Supongamos que la concentración tanto del reactante como del producto son iguales. En ese caso, la flecha de reacción de equilibrio se asemeja a la flecha de reacción reversible. La longitud de la flecha es la misma.
Sin embargo, en ocasiones, al modificar las condiciones de reacción, es posible cambiar la dirección de la reacción favoreciendo la formación de los reactivos o de los productos.
Una flecha de reacción hacia adelante más larga indica que la reacción hacia adelante ocurre más que la reacción inversa. Sin embargo, cuando la reacción inversa es dominante, la longitud de la flecha es mayor.
Momento dipolar
La flecha del momento dipolar va paralela a los enlaces y apunta hacia el átomo más electronegativo. Una forma sencilla de saber qué lado es electronegativo y qué lado es electropositivo es recordar que el extremo electropositivo de la flecha tiene un signo más incorporado.
Liberación de gas
Una flecha vertical hacia arriba representa la formación de un gas. El gas se eleva y se aleja, de ahí la flecha hacia arriba. Estas flechas a menudo se omiten, especialmente si se especifica el estado físico de los productos.
Precipitación
Una flecha vertical hacia abajo representa la formación de un precipitado sólido en solución. El precipitado cae hacia la parte inferior del matraz de reacción, donde se asentará, de ahí la flecha hacia abajo. Estas flechas a menudo se omiten, especialmente si se especifica el estado físico de los productos.
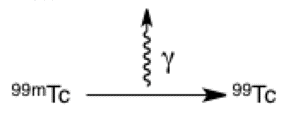
Movimiento de fotones
La flecha ondulada representa un fotón de luz o energía que se libera. Se utiliza con frecuencia en el contexto de flechas de reacción, para mostrar el movimiento entre diferentes niveles de energía (que se estudiarán en química física) y en dibujos de colisiones (más relacionados con la física nuclear). En este ejemplo, el tecnecio metastable está liberando energía en forma de un rayo gamma; sin tanta energía adicional, se forma el tecnecio-99 estable.
Ocupación de niveles de electrones
Las medias flechas verticales se observan en el contexto de la ocupación orbital. Cada media flecha representa un electrón, y en cada subcapa orbital (representada por una línea horizontal etiquetada) pueden caber dos electrones. A veces también se utilizan dos flechas verticales completas para representar la ocupación electrónica.
Flechas en Química Orgánica
En química orgánica, aparte de las flechas usadas en química general, se emplean adicionalmente otras flechas para indicar procesos comunes en las reacciones orgánicas.
Flecha de doble punta
La flecha de doble punta es una flecha curva que muestra el movimiento de un par de electrones; se utiliza frecuentemente en la representación de mecanismos en química orgánica. Recuerda que las flechas muestran el movimiento de los electrones y apuntan hacia donde se dirigen los electrones. Los electrones pueden estar en forma de pares solitarios o de los dos electrones que forman cada enlace.
Es un error común utilizar incorrectamente las flechas curvas de doble punta. No utilices accidentalmente la flecha de doble punta para representar el movimiento de cualquier otra cosa que no sean electrones, especialmente cargas positivas. Solo electrones. ¡Electrones! En este ejemplo, estas dos estructuras también están en resonancia.

Flecha de punta simple
La flecha de una sola punta o punta simple representa un solo electrón en lugar de un par de electrones. El electrón individual puede provenir de un orbital que contiene solo un electrón o dos electrones individuales pueden provenir de un enlace (en lugar de moverse juntos como un par). Es menos común que la flecha de doble punta y solo se utiliza en reacciones de radicales. En este ejemplo de escisión homolítica de enlace, los dos electrones en el enlace se dirigen hacia átomos diferentes, produciendo dos radicales equivalentes.
Etapa propuesta
Una flecha de línea discontinua representa un paso propuesto en una síntesis. La reacción podría no funcionar; ¡necesitas realizar el experimento para averiguarlo! Estas flechas se utilizan con más frecuencia en síntesis planificadas en la vida real que en el aula.
Sin reacción
La flecha para indicar que no hay reacción puede ser una flecha con una cruz en su interior (como se muestra en la tabla) o con líneas dobles. Esta flecha representa una reacción que no ocurre y se utiliza comúnmente para ilustrar errores. Otra razón por la que se podría mostrar una reacción que no funciona es para listar explícitamente reacciones que deberían funcionar teóricamente, pero que no se desarrollan como se espera en la vida real.
Flecha retrosintética
La flecha retrosintética apunta desde un producto hasta un material de partida (también llamado «sintón»), en lugar de al revés. Te indica que debes trabajar en sentido contrario, de modo que la estructura de la derecha se utiliza para sintetizar la estructura de la izquierda. La retrosíntesis se utiliza a menudo cuando se conoce el producto deseado, pero es necesario planificar una ruta para fabricarlo realmente. En este ejemplo, Raymond Funk utilizó el pensamiento retrosintético para descubrir cómo hacer el producto (izquierda) y se dio cuenta de que se podía lograr utilizando la estructura de la derecha.
Pasos múltiples o múltiples etapas de síntesis
Las flechas múltiples apiladas y que miran en la misma dirección representan varias etapas sintéticas que se completan sin especificación. Esto te permite mostrar los materiales de partida iniciales y el producto final sin mostrar todos los intermediarios en la ruta sintética completa. Se utiliza con frecuencia en las síntesis largas de productos naturales.
Rearreglo
La flecha de reordenamiento tiene un bucle en el medio para representar el reordenamiento de enlaces. Esta flecha no se utiliza con demasiada frecuencia, pero puede aparecer. Es simultáneamente una flecha de reacción normal y muestra el movimiento intramolecular de electrones dentro de una sola molécula.
Hay muchos reordenamientos nombrados, como el reordenamiento de Claisen, pero los reordenamientos también ocurren con frecuencia para estabilizar radicales o carbocationes. Es importante tener en cuenta que los reordenamientos no son lo mismo que los equivalentes (a continuación) porque implican la formación/rotura de enlaces y no solo la rotación alrededor de un eje.
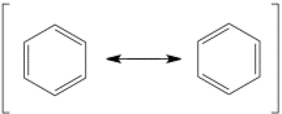
Flecha de resonancia
La flecha de resonancia se confunde comúnmente con la flecha de equilibrio. La flecha de resonancia tiene dos cabezas con dos púas, mientras que la flecha de equilibrio tiene dos flechas con medias púas. Las flechas de resonancia se utilizan comúnmente con corchetes alrededor de todas las posibles estructuras de resonancia, pero no siempre.
Estas dos estructuras del benceno están en resonancia: se representan como estructuras separadas, pero realmente existen como una combinación de las dos al mismo tiempo. Si esto es confuso, simplemente reconoce que la molécula nunca es realmente una u otra durante un tiempo estable. La resonancia puede incluir muchas estructuras diferentes, cada una contribuyendo en diferentes proporciones a la estructura electrónica real.
Equivalencia
Tres líneas apiladas se utilizan a menudo para mostrar dos estructuras equivalentes que se dibujan de manera diferente. Esto ocurre cuando una molécula se redibuja para que los enlaces parezcan estar mejor dispuestos para una reacción.
Si observas la reacción de reordenamiento mencionada anteriormente, la estructura equivalente en la derecha es mucho más fácil de reconocer como el producto de un reordenamiento de Claisen que la estructura de la izquierda.
También se utiliza con frecuencia para mostrar la misma molécula en diferentes formalismos de representación que incluyen fórmulas de líneas de enlace, formas condensadas, proyecciones de Fisher, proyecciones de Newman y más.
Asegúrate de tener en cuenta que los enlaces solo pueden rotar alrededor de enlaces sp3 a sp3; los enlaces pi no rotan. También es posible ver el signo de igual estándar utilizado para mostrar la equivalencia.
Flechas estereoquímicas
Si no has escuchado la frase «prioridad de Cahn-Ingold-Prelog», probablemente puedas omitir las flechas estereocémicas por ahora. El primer tipo de flecha estereocémica se utiliza para la designación de S (en sentido antihorario) o R (en sentido horario), comenzando desde el grupo más grande y avanzando hacia el más pequeño según las reglas de prioridad.
En mis ejemplos, los grupos están etiquetados simplemente como pequeño (S), mediano (M), grande (L) o hidrógeno. La figura de la izquierda muestra una representación tridimensional de una molécula. La figura de la derecha muestra una vista hacia abajo del eje del enlace C-H (línea discontinua; imagina el H detrás del vértice central) con una flecha para mostrar la dirección de la prioridad descendente, que en este caso es S.
El segundo tipo de flecha estereocémica se utiliza para mostrar la rotación de un enlace sigma alrededor de un eje que, en este caso, es a través del enlace C—L paralelo a la línea discontinua. Esta flecha suele ser una elipse aplanada en lugar de un círculo para dar al espectador una sensación de perspectiva. Esta flecha puede omitirse ya que las dos estructuras son equivalentes y el signo de igual sería suficiente, pero puede ser útil para el auto-seguimiento y para que otros puedan seguir mejor el trabajo.
Para más información A guide to deciphering chemistry arrows
Como citar este artículo:
APA: (2023-09-21). Flechas en química. Recuperado de https://quimicafacil.net/notas-de-quimica/flechas-en-quimica/
ACS: . Flechas en química. https://quimicafacil.net/notas-de-quimica/flechas-en-quimica/. Fecha de consulta 2026-02-26.
IEEE: , "Flechas en química," https://quimicafacil.net/notas-de-quimica/flechas-en-quimica/, fecha de consulta 2026-02-26.
Vancouver: . Flechas en química. [Internet]. 2023-09-21 [citado 2026-02-26]. Disponible en: https://quimicafacil.net/notas-de-quimica/flechas-en-quimica/.
MLA: . "Flechas en química." https://quimicafacil.net/notas-de-quimica/flechas-en-quimica/. 2023-09-21. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net