Tiempo de lectura estimado: 5 minutos
El estudio de la síntesis de compuestos de coordinación (como el cloruro de hexaaminocobalto (III)) nos permite investigar sobre los fenómenos fisicoquímicos que reinan en las interacciones atómicas y moleculares, así como su efecto en las propiedades físicas, químicas y biológicas de los compuestos.
La interacción entre el átomo central del complejo y los ligandos altera el comportamiento químico, generando posibilidades para el uso de compuestos de coordinación en campos que van desde la investigación científica, medicina y farmacéutica hasta el desarrollo de materiales inteligentes.
El cloruro de hexaaminocobalto (III) es un compuesto de coordinación con formula [Co(NH3)6]Cl3. Químicamente es la sal de cloruro del complejo de coordinación [Co(NH3)6]3+, que es considerado el modelo estándar de un complejo de Werner, llamado así en honor al pionero de la química de coordinación Alfred Werner, y consiste en un núcleo de cobalto (III) unido a seis ligandos amoniaco. El cloruro de hexaaminocobalto (III) se usa especialmente en métodos de biología molecular para resolver estructuras de DNA y RNA empleando cristalografía de rayos – X o resonancia magnética nuclear.
Compuestos de coordinación
En términos generales, un complejo es una entidad conformada por la asociación o unión de dos a más componentes (compuestos o elementos) unidos por un tipo de enlace químico especial, denominado enlace de coordinación.
Los compuestos de coordinación se pueden definir como un tipo de estructura molecular formada por un átomo central, generalmente un catión metálico, enlazado a otras entidades moleculares, que reciben el nombre de ligandos.
El descubrimiento de los compuestos de coordinación o complejos se dio a partir del impulso en la síntesis de sustancias inorgánicas en el siglo XVIII. Los científicos de la época sintetizaron sustancias que les resultaron llamativas por sus colores intensos y generalmente, al desconocerse la naturaleza de dichas sustancias, recibieron el nombre de sus creadores, como, por ejemplo, la sal de Magnus (2PtCl
2·2NH3).
No fue sino hasta mediados del siglo XIX en que se iniciaron los estudios para determinar la naturaleza de estos compuestos, y se llegó a la conclusión que estaban compuestos por la asociación de otros compuestos mas sencillos, y se les dio el nombre de compuestos moleculares, aunque con el tiempo, este nombre se transformó a complejos.
La explicación total sobre el comportamiento de los compuestos de coordinación aun no se ha logrado, y existen muchas teorías que explican los fenómenos que se observan desde el punto de vista de la química cuántica.
Los compuestos de coordinación tienen muchas aplicaciones en campos como la medicina, pinturas y recubrimientos, investigación y química de materiales.
Materiales
- Vasos de precipitados de 50, 100, 250 y 1000 mL
- Erlenmeyers de 100 y 250 mL
- Embudo de decantación
- Embudo de vidrio
- Papel filtro
- Pipeta graduada de 10 mL
- Pipeteador o propipeta
- Pipeta Pasteur
- Agitador de vidrio
- Termómetro
- Soporte universal
- Aro con nuez
- Vidrio de reloj
- Balanza analítica
- Plancha de calentamiento
Reactivos
- Cloruro de cobalto hexahidratado
- Cloruro de amonio
- Carbón activado
- Amoniaco
- Etanol 95%
- Solución de peróxido de hidrogeno 30%
- Ácido clorhídrico concentrado
- Hielo
Procedimiento
Tiempo necesario: 50 minutos
Síntesis de cloruro de hexaaminocobalto (III)
Pesar 5 g de cloruro de cobalto hexahidratado y mezclar con 3,3 g de cloruro de amonio en un erlenmeyer de 250 mL junto con 30 mL de agua destilada.
Llevar a una cabina de extracción de gases y añadir 1 g de carbón activado y 45 mL de amoniaco concentrado, mezclar y colocar el conjunto en un baño de hielo.
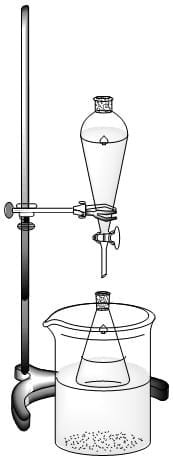
Con ayuda de un soporte universal, aro y nuez, realizar un montaje con el embudo de decantación para añadir gota a gota 4 mL de solución de peróxido de hidrogeno al 30%. Monitorizar la temperatura para asegurar que no pase de 10°C.

Una vez se observe que la efervescencia en el erlenmeyer ha cesado, calentar el conjunto hasta 60 °C con agitación constante. Mantener el calentamiento a esta temperatura por 30 minutos.
AnuncioEnfriar el conjunto nuevamente con ayuda de un baño de hielo y observar precipitación. Filtrar.
Colocar el sólido recuperado en un erlenmeyer de 100 mL y añadir 40 mL de agua caliente y 1 mL de ácido clorhídrico concentrado. Calentar hasta 70 °C y filtrar en caliente.
Enfriar el liquido obtenido en un baño de hielo y añadir 1 mL de acido clorhídrico concentrado frio. Filtrar el precipitado de cloruro de hexaaminocobalto (III) de color naranja obtenido por filtración y lavar con 25 mL de etanol frio. Dejar secar al ambiente.
Después del experimento
Escribir las reacciones balanceadas involucradas en la sintesis de cloruro de hexaaminocobalto (III).
Describir las formas adoptados por los cristales, indagar en la literatura sobre la estructura cristalina del cloruro de hexaaminocobalto (III) y compare con lo observado.
Recomendaciones de seguridad
Cuando se manejan soluciones concentradas de amoniaco, se debe evitar la inhalación de sus vapores, que pueden ser tóxicos.
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información Experiment 6: Synthesis of a Coordination Compound
Clasificación
Nivel: Universitario
Tipo: Practica de enseñanza
Riesgo: medio
Como citar este artículo:
APA: (2019-07-03). Síntesis de cloruro de hexaaminocobalto (III). Recuperado de https://quimicafacil.net/manual-de-laboratorio/sintesis-de-cloruro-de-hexaaminocobalto-iii/
ACS: . Síntesis de cloruro de hexaaminocobalto (III). https://quimicafacil.net/manual-de-laboratorio/sintesis-de-cloruro-de-hexaaminocobalto-iii/. Fecha de consulta 2026-03-05.
IEEE: , "Síntesis de cloruro de hexaaminocobalto (III)," https://quimicafacil.net/manual-de-laboratorio/sintesis-de-cloruro-de-hexaaminocobalto-iii/, fecha de consulta 2026-03-05.
Vancouver: . Síntesis de cloruro de hexaaminocobalto (III). [Internet]. 2019-07-03 [citado 2026-03-05]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/sintesis-de-cloruro-de-hexaaminocobalto-iii/.
MLA: . "Síntesis de cloruro de hexaaminocobalto (III)." https://quimicafacil.net/manual-de-laboratorio/sintesis-de-cloruro-de-hexaaminocobalto-iii/. 2019-07-03. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net