Tiempo de lectura estimado: 11 minutos
Método de Hittorf
La determinación del número de transporte se puede hacer con el método de Hittorf. Este método se basa en el principio de que los cambios de concentración se producen alrededor de los electrodos debido a la migración de los iones. El aparato utilizado, llamado aparato de Hittorf consiste en un tubo en forma de U, conectado por un lado al «miembro del ánodo» y por el otro lado al «miembro del cátodo».
El ánodo está hecho de plata y el cátodo está hecho de metal de platino. El tubo en U, el miembro anódico y el miembro catódico están llenos de una solución estándar de nitrato de plata (AgNO3). El aparato está conectado en serie a un voltímetro. Se pasa una corriente constante de unos 0,01 amperios durante unas dos o tres horas. Después de eso, las llaves de paso S1 y S2 se cierran.
La totalidad de la solución de la extremidad del ánodo se saca a través de la llave de paso S3 en un frasco pesado. El contenido de plata de esta solución se determina por el método de Volhard. También se determina el peso de la plata depositada en el voltímetro de plata.
En una disolución de un electrolito en el seno de un campo eléctrico tanto los cationes como los aniones contribuyen al transporte de carga (q), es decir, a la corriente eléctrica en el seno de la disolución. Los números de transporte t+ y t– caracterizan la participación de cada tipo de ión en la corriente eléctrica (I+, I–) y en el transporte de carga (q+, q–), respectivamente.
Los números de transporte se definen como:

De donde fácilmente se obtiene, que la suma de los dos números de transporte es igual a la unidad (uno):
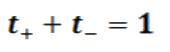
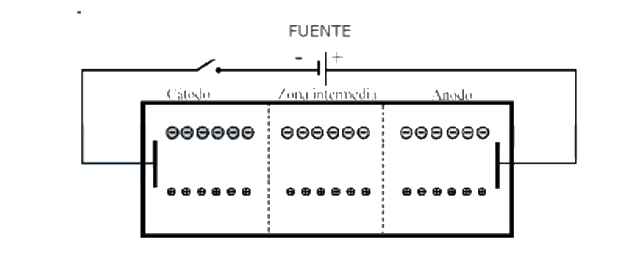
Según las anteriores ecuaciones los números de transporte están relacionados con las movilidades iónicas U+ y U-, y con las conductividades equivalentes Λ+ y Λ- siendo, por tanto, funciones de la velocidad de migración de cada contraión. Las cantidades de catión y de anión que se transportan respectivamente durante la electrolisis son proporcionales a las movilidades de cada tipo de ion. Si éstas difieren entre sí (U+ ≠ U-), dado que la neutralidad eléctrica debe mantenerse en todo momento, se producirán alteraciones de la concentración de electrolito en el ánodo y en el cátodo como se ilustra en el esquema siguiente para la electrolisis de una disolución diluida de HNO3:
Antes de la electrolisis
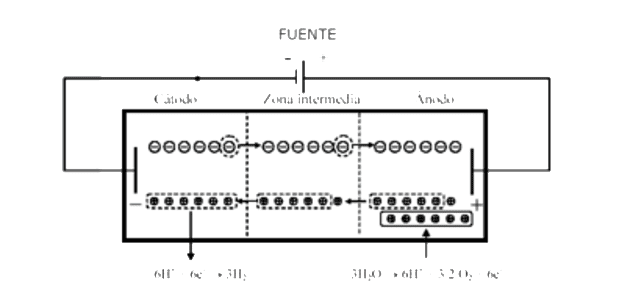
Durante la electrolisis de 6 equivalentes
Después de la electrolisis
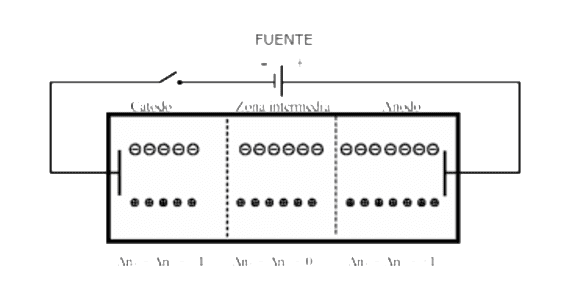
Debido a la mayor movilidad de cationes, se transportan más iones hidronio en la dirección del cátodo que iones nitrato en la dirección del ánodo. Los iones hidronio se reducen a hidrógeno en el cátodo, manteniéndose la electroneutralidad en toda la disolución. Gracias a su mayor potencial de oxidación, los iones nitrato no se descargan en el ánodo, sino que se produce la electrolisis del agua con la formación de una cantidad equivalente de iones hidronio en el compartimento anódico. De esta forma, se produce una acumulación de iones nitrato y de iones hidronio (ácido nítrico) en el compartimento anódico y un defecto equivalente en el compartimento catódico.
Las cantidades de cationes (Δn+), aniones (Δn–) y electrolito (Δn) en las regiones del cátodo (C) y del ánodo (A) cambian durante la electrolisis según:
Según estas ecuaciones determinando los cambios en la cantidad de electrolito en cualquiera de las regiones anódica o catódica, puede calcularse la cantidad de carga transportada por los aniones. Sin embargo, es conveniente para minimizar errores combinar ambas ecuaciones para obtener la ecuación siguiente:
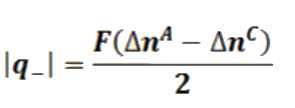
Determinando los cambios de concentración de electrolito en las regiones anódica y catódica se puede calcular. Esto se hace analizando las disoluciones en cada compartimiento antes y después de la electrolisis.
La cantidad total de electricidad utilizada en la electrolisis puede medirse a partir de los cambios de masa de los electrodos de un coulombimetro de cobre. Este coulombímetro se basa en dos electrodos de cobre sumergidos en una disolución de H2SO4 (0.05 M)/CuSO4 (0.5 M) y conectado en serie al circuito de electrolisis.
En los electrodos del coulombímetro se produce las semirreacciones:

La carga total que pasa por el circuito viene dada por:

Donde:
Z = 2, número de carga de la reacción en el coulombímetro de cobre.
M = 63.54 g/mol, peso atómico del cobre.
ΔmC y ΔmA : cambios de masa del cátodo y del ánodo de cobre después de la electrolisis.
F = constante de Faraday [96500 coulombios/seg]
Combinando las anteriores dos ecuaciones con las definiciones de los números de transporte podemos calcular el número de transporte del anión:

El número de transporte del catión se halla de la diferencia t+=1-t–
El ensayo se puede realizar también utilizando otros ácidos, en lugar del nítrico, se puede realizar con ácido clorhídrico 0.1 M ó con sulfúrico 0.1 M.
Materiales

- Fuente de alimentación
- 4 cables de corriente
- Multimetro digital
- Aparato de Hittorf
- Termómetro
- Cronometro
- 2 electrodos de platino o grafito
- 2 pinzas para electrodos
- Soporte de electrodos de lamina
- 2 soportes universales
- 2 buretas, 1 de 10 mL y 1 de 50 mL
- Erlenmeyer de 250 mL
- Erlenmeyer de 100 mL
- 2 balones aforados de 1000 mL
- Embudo de vidrio
- Balón de aforado de 250 mL
- Frasco lavador
Reactivos
- Ácido nítrico 0.1 M
- Solución para coulombimetro
- Hidróxido de sodio 0.1 M
- Solución indicadora de fenolftaleína
Procedimiento
Tiempo necesario: 4 horas y 30 minutos
Determinación del número de transporte con el método de Hittorf
Preparar las siguientes soluciones
100 mL de hidróxido de sodio 0.1 M
50 mL de ácido nítrico 0.1 M
250 mL de ácido sulfúrico 0.05 M / sulfato de cobre 0.5 MRealizar el montaje mostrado a continuación

Llenar los compartimientos del aparato de Hittorf con la disolución de HNO3 0.1 M
Introducir los electrodos de platino o grafito e igualar el nivel de disolución de electrolito en las ramas del aparato de Hittorf.
AnuncioPesar el ánodo y el cátodo de cobre del coulombímetro en la balanza de precisión. Anotar dicho valor
Fijar cada electrodo de cobre en su soporte correspondiente y sumergirlos en un vaso de 250 mL con la disolución coulombimétrica de H2SO4/CuSO4.
Conectar el coulombímetro, el aparato de Hittorf y el multímetro en serie como se indica en el esquema anterior. Conectarlos a la fuente de alimentación.
Una vez conectado el circuito eléctrico, encender la fuente de alimentación y poner en funcionamiento simultáneamente el cronómetro. Realizar la electrolisis durante unos 90 – 120 min a una intensidad de corriente menor de 3 amperios en la fuente de alimentación.
AnuncioComprobar que la intensidad de corriente es aproximadamente constante. Medir exactamente el tiempo de duración de la electrolisis durante unos 90 – 120 min a una intensidad de corriente menor de 3 Amperios en la fuente de alimentación.
Comprobar que la intensidad de corriente es aproximadamente el tiempo de duración de la electrolisis.
Durante el periodo de electrolisis valorar la disolución de hidróxido de sodio con biftalato potásico utilizando fenolftaleína como indicador. Posteriormente utilizando la disolución de hidróxido valorada, titular la disolución de ácido nítrico, para tener el valor real de su concentración.
Al final del periodo de electrolisis, colocar la pinza para interrumpir los volúmenes de disolución de las regiones anódica y catódica del aparato de Hittorf
AnuncioRegistrar el tiempo exacto total de electrolisis.
Rotular dos Erlenmeyers de 100 mL como “cátodo” y “ánodo”.
Medir los volúmenes de las disoluciones de las regiones catódica y anódica. Anotar este dato en la tabla respectiva. Pasar los volúmenes a los respectivos erlenmeyer rotulado.
AnuncioTitular los volúmenes de las disoluciones anódica y catódica por separado y reportar los volúmenes de hidróxido de sodio 0.1 M gastado para cada Erlenmeyer. Anotar los valores.
Lavar los electrodos de cobre del coulombímetro con agua destilada y secarlos cuidadosamente con aire. Pesarlos exactamente para determinar el cambio de masa durante la electrolisis.
Después del laboratorio
Anotar los valores obtenidos en la practica en las siguientes tablas


Los cambios de concentración del electrolito en la región catódica y anódica ΔnC y ΔnA, se calcula realizando la diferencia de moles del electrolito (ácido nítrico), antes y después de la electrolisis.
Así para hallar

se realiza el cálculo para saber el número de moles de ácido nítrico, que contenía inicialmente la disolución en el cátodo, esto es, conocido el volumen en mililitros y la concentración según la fórmula:

Para hallar el número de moles de ácido nítrico al final, se utilizan los datos obtenidos de la titulación de la disolución catódica con hidróxido de sodio, como se expresa en la siguiente fórmula:

Para hallar ΔnA, se procede de la misma manera utilizando los datos respectivos de la celda del ánodo.
Para más información Hittorf’s Method for Determination of Transport Number
Como citar este artículo:
APA: (2020-08-05). Determinación del número de transporte con el método de Hittorf. Recuperado de https://quimicafacil.net/manual-de-laboratorio/numero-transporte-hittorf/
ACS: . Determinación del número de transporte con el método de Hittorf. https://quimicafacil.net/manual-de-laboratorio/numero-transporte-hittorf/. Fecha de consulta 2026-03-09.
IEEE: , "Determinación del número de transporte con el método de Hittorf," https://quimicafacil.net/manual-de-laboratorio/numero-transporte-hittorf/, fecha de consulta 2026-03-09.
Vancouver: . Determinación del número de transporte con el método de Hittorf. [Internet]. 2020-08-05 [citado 2026-03-09]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/numero-transporte-hittorf/.
MLA: . "Determinación del número de transporte con el método de Hittorf." https://quimicafacil.net/manual-de-laboratorio/numero-transporte-hittorf/. 2020-08-05. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net
