Tiempo de lectura estimado: 5 minutos
La constante o número de Avogadro, llamada así en honor al científico italiano Amadeo Avogadro, que en 1811 propuso que el volumen de un gas a presión y temperatura dadas es proporcional al número de átomos o moléculas independiente del tipo de gas. Sin embargo, fue el físico Jean Perrin quien propuso que este numero o constante llevara el nombre del científico italiano.
Número de Avogadro
La primera aproximación al valor del número de Avogadro se estableció en 1870 y se definió como la cantidad de átomos necesarios para obtener la masa atómica del elemento en gramos.
El número de Avogadro corresponde a un número de cosas o partes, denominado mol. Por ejemplo, cuando se tiene 12 unidades de cualquier cosa se dice que este valor corresponde a una docena, otro ejemplo sería cuando se tiene 10 unidades de algo, sería lo mismo que decir que este número corresponde a una decena.
Así mismo, el número de Avogadro corresponde a una cantidad equivalente a 6,023×10 23 unidades que, a su vez, corresponde a un mol de sustancia. Por ejemplo, si tenemos 6,023×1023 personas sería equivalente a decir 1 mol de personas, de esta forma se puede hablar de 1 mol de manzanas, átomos etc., que corresponderán siempre al número de Avogadro.
Por lo tanto, un mol de cualquier elemento corresponderá al número de Avogadro, es decir, 6,023×1023 átomos del elemento, por ejemplo: un mol de hidrógeno corresponde a 6,023×1023 átomos de Hidrógeno y esta cantidad de átomos de hidrógeno pesan 1 gramo; otro ejemplo sería un mol de átomos de carbono que corresponden a 6,023×1023 átomos de carbono y esta cantidad pesa 12 gramos, esta relación se aplica para todos los elementos de la tabla periódica.
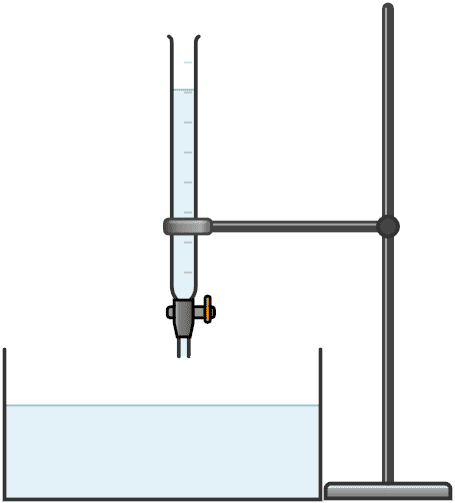
Materiales
- Bureta de 25 mL
- Regla graduada en mm
- Recipiente amplio (aproximadamente 40*30 cm) con poca profundidad
Reactivos
- Solución de ácido esteárico en éter de petróleo 2,5*10-4 g/mL
- Ácido oleico
- Alcohol cetílico (1-hexadecanol)
- Talco en polvo fino o tiza en polvo
Procedimiento
Tiempo necesario: 1 hora
Determinación del número de Avogadro
Llenar con agua hasta aproximadamente 1 cm del borde, el recipiente amplio de poca profundidad y esperar a que el agua quede en reposo. Esparcir uniformemente polvo fino de talco o tiza, creando una capa delgada.
En el centro del recipiente, y desde una altura aproximadamente de 5 cm, dejar caer una gota de solución de ácido esteárico en éter. Se debe tener cuidado con la evaporación del éter para evitar que se altere la concentración de la solución.
Esperar unos minutos para que el solvente se evapore de la superficie del agua, y permita que el soluto forme una película monomolecular. Cubrir el recipiente con un vidrio, y con la ayuda de un marcador fino, copie el contorno de la marcha formada.
Repetir el anterior procedimiento 5 veces o mas para obtener un valor promedio del área de la capa monomolecular que forma el ácido esteárico contenido en una gota de solución. Anotar los valores obtenidos.
AnuncioEmpleando la misma bureta que se utilizó para depositar las gotas de solución, contar el numero de gotas contenidas en 1.0 mL de solución. Repetir el procedimiento mínimo 5 veces para obtener un valor promedio del numero de gotas por mililitro de solución.
Después del experimento
Teniendo en cuenta la concentración de la solución de trabajo y el numero promedio de gotas en un mL de solución, calcular los gramos de ácido esteárico presentes en una gota de solución.
Consultar la densidad del ácido esteárico y con la masa del acido esteárico calculada anteriormente, calcular el volumen de acido presente en una gota de solución, y, por lo tanto, el volumen de la monocapa formada sobre la superficie del agua.
Empleando el valor promedio del área de la capa monomolecular y el valor del volumen obtenido en el paso anterior, calcular el espesor de la capa monomolecular tanto en cm como en angstroms.
Si se asume que se formó una capa monomolecular, es decir, que una sola molécula de ácido esteárico ocupa la altura de la capa, podemos calcular el volumen que ocupa una molécula de ácido empleando como diámetro la altura de la monocapa. Posteriormente, dividiendo el volumen total de la monocapa en el valor del volumen que ocupa una molécula de ácido.
Es necesario determinar el número de moles de ácido esteárico presentes en la monocapa, para obtener este valor se divide la masa de ácido en el peso molecular del mismo.
Como se tienen tanto el número de moléculas como el número de moles de ácido esteárico presentes en la monocapa, se pueden relacionar para determinar el número de moléculas presentes en una mol, o lo que es lo mismo, el número de Avogadro.
Todo el anterior procedimiento se puede repetir con una solución de alcohol cetílico o ácido oleico en éter de petróleo, ya que estas moléculas grandes tienden a formar capas monomoleculares sobre superficies.
Calcular el porcentaje de error en el valor obtenido del número de Avogadro y proponer alternativas para disminuir el error.
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Mayor información
Lab 1: Determination of Avogadro’s Number
Como citar este artículo:
APA: (2019-11-13). Determinación del número de Avogadro. Recuperado de https://quimicafacil.net/manual-de-laboratorio/numero-de-avogadro/
ACS: . Determinación del número de Avogadro. https://quimicafacil.net/manual-de-laboratorio/numero-de-avogadro/. Fecha de consulta 2026-02-14.
IEEE: , "Determinación del número de Avogadro," https://quimicafacil.net/manual-de-laboratorio/numero-de-avogadro/, fecha de consulta 2026-02-14.
Vancouver: . Determinación del número de Avogadro. [Internet]. 2019-11-13 [citado 2026-02-14]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/numero-de-avogadro/.
MLA: . "Determinación del número de Avogadro." https://quimicafacil.net/manual-de-laboratorio/numero-de-avogadro/. 2019-11-13. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net