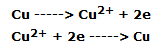Tiempo de lectura estimado: 4 minutos
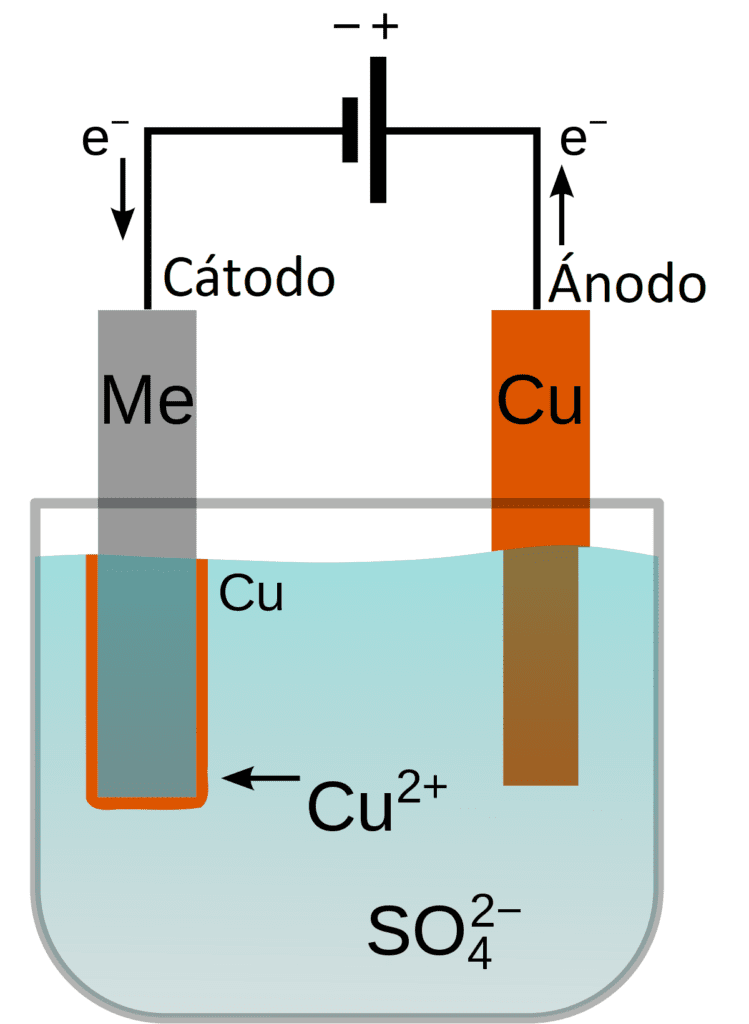
La galvanoplastia, electroplatinado o galvanizado es un nombre general para los procesos que crean un revestimiento metálico sobre un sustrato sólido mediante la reducción de cationes de ese metal por medio de una corriente eléctrica directa. La pieza que se va a recubrir actúa como cátodo (electrodo negativo) de una célula electrolítica; el electrolito es una solución de una sal del metal que se va a recubrir; y el ánodo (electrodo positivo) suele ser un bloque de ese metal o de algún material conductor inerte. La corriente es suministrada por una fuente de alimentación externa.
La galvanoplastia se utiliza ampliamente en la industria y en las artes decorativas para mejorar las cualidades superficiales de los objetos, como la resistencia a la abrasión y a la corrosión, la lubricidad, la reflectividad, la conductividad eléctrica o el aspecto. También puede utilizarse para aumentar el grosor de las piezas de tamaño insuficiente o desgastadas, o para fabricar placas metálicas con formas complejas, un proceso denominado electroformación. También se utiliza para purificar metales como el cobre.
El término «galvanoplastia» también puede utilizarse ocasionalmente para procesos que utilizan una corriente eléctrica para lograr la oxidación de aniones sobre un sustrato sólido, como en la formación de cloruro de plata sobre alambre de plata para fabricar electrodos de plata/cloruro de plata.
El electropulido, un proceso que utiliza una corriente eléctrica para eliminar cationes metálicos de la superficie de un objeto metálico puede considerarse lo contrario de la galvanoplastia.
Materiales
- Generador de corriente continua de 6 voltios
- Cables con pinza de cocodrilo
- Vaso de precipitados de 500 mL
- Probeta graduada de 250 mL
Reactivos
- Sulfato de cobre sol. 10/20 %
- Lámina de cobre
- Objeto de aleación de hierro (por ejemplo, una moneda)
- Hidróxido de sodio sol. 4 M
- Ácido clorhídrico sol. 1:3
- Acetona
Procedimiento de galvanoplastia
El primer paso es el llamado decapado, es decir, el desengrasado y la limpieza del objeto a recubrir. Se debe frotar con un trapo empapado en acetona y luego sumergirlo en una solución de ácido clorhídrico sol. 1:3 y luego en una solución de hidróxido de sodio 4 M. Por último, lavar con agua destilada y secar.
A continuación, conectar la lámina de cobre a la pinza cocodrilo del cable que viene del polo positivo del generador y el objeto de aleación de hierro al terminal del cable conectado al polo negativo.
El ánodo y el cátodo se sumergen en la solución galvánica colocada en un vaso de precipitados (sulfato de cobre de concentración entre 10 – 20%) y se enciende el generador. En poco tiempo se observa la aposición del cobre elemental sobre el objeto ferroso, fenómeno que se hace más evidente y completo al cabo de unos minutos.
Al cabo de este tiempo se desconecta el generador, se retira el objeto y se observa que el revestimiento está tan íntimamente unido al metal que no puede eliminarse por frotamiento.
Las reacciones oxidorreductoras que se han producido son las siguientes:
Nota: hay que evitar que el ánodo y el cátodo estén demasiado cerca; esto provocaría una superposición demasiado rápida y masiva que podría adquirir un color negruzco. El objeto por recubrir debe girarse varias veces para que la aplicación electrolítica de cobre sea lo más uniforme posible.
Se debe tener cuidado al manejar el ánodo y cátodo en especial cuando hay corriente en circulación. A pesar de que el voltaje es bajo, puede causar malestar o dañar el equipo en caso de hacer contacto con tierra.
Después del laboratorio.
Empleando los datos de voltaje y corriente de la fuente empleada en el experimento y el área a recubrir, calcular el tiempo necesario para generar una capa de cobre uniforme de 1 micra de espesor empleando galvanoplastia.
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información Electroplating
Como citar este artículo:
APA: (2021-07-07). Galvanoplastia. Recuperado de https://quimicafacil.net/manual-de-laboratorio/galvanoplastia/
ACS: . Galvanoplastia. https://quimicafacil.net/manual-de-laboratorio/galvanoplastia/. Fecha de consulta 2026-03-04.
IEEE: , "Galvanoplastia," https://quimicafacil.net/manual-de-laboratorio/galvanoplastia/, fecha de consulta 2026-03-04.
Vancouver: . Galvanoplastia. [Internet]. 2021-07-07 [citado 2026-03-04]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/galvanoplastia/.
MLA: . "Galvanoplastia." https://quimicafacil.net/manual-de-laboratorio/galvanoplastia/. 2021-07-07. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net