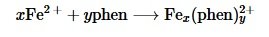Tiempo de lectura estimado: 7 minutos
La estequiometria de reacción da los coeficientes necesarios para que una ecuación química exprese en su totalidad las características de una reacción determinada. Para poder escribir una ecuación química, se deben identificar los reactantes y los productos, así como la proporción en los cuales los reactivos se consumen y los productos se generan.
Estequiometria de reacción
Cuando dos o mas especies se mezclan y se genera una reacción, esta puede ser seguida a través de los cambios en las propiedades de la mezcla. gracias a esto, y variando las cantidades de moles de cada reactivo, es posible determinar el numero necesario de moles de cada reactivo que generan una relación estequiométrica de los mismos, por ende, se obtendrá la estequiometria de reacción.
Como ejemplo podemos considerar una reacción sencilla, donde dos reactivos A y B se mezclan para producir el producto P. la ecuación química la podemos escribir como
Donde x, y y z representan la cantidad de moles que se requieren para que la ecuación este balanceada estequiométricamente. Las mezclas de reactivos son escogidas cuidadosamente para que la suma de las moles de A y B sean constantes, y la cantidad de producto formado P se mide. Este método es conocido como método de variación continua. Si A o B se encuentran en exceso, el exceso permanecerá en la solución en vez de formar el producto. La máxima cantidad de P es formada cuando A y B se mezclan en las cantidades estequiométricas correctas.
Supongamos que x=3 y y=2, y el total de moles de A y B se mantiene fijo en 0.10 moles. La cantidad de producto formado será máximo cuando la relación A:B sea 3:2, esto es cuando A=0.06 moles y B=0.04 moles.
Se puede observar que, a la izquierda del máximo, donde las moles de A son menores a 0.06, no hay suficiente reactivo A para reaccionar con todo el B presente, generando menos producto P. al lado derecho del máximo la situación se invierte, no hay suficiente B para reaccionar con todo el A presente, y de nuevo, no se puede producir todo el producto P posible. Debido a que la cantidad de A+ B es constante, la máxima cantidad de producto se forma cuando la relación A:B es estequiométrica.
Una reacción que se puede estudiar con esta técnica es la reacción de generación de un complejo metálico. Los iones metálicos, especialmente los metales de transición, poseen la habilidad de formar complejos con moléculas orgánicas e inorgánicas llamadas ligandos. Esos complejos se producen cunado los pares desapareados de electrones del ligando son donados a los orbitales vacíos del ion metálico, generándose un enlace covalente coordinado. En esta ocasión, se mezclarán cationes de hierro (II) con el ligando 1,10 fenantrolina para producir el complejo hierro (II) – fenantrolina:
Usando el método de la variación continua, varias soluciones de reactivos se preparan variando la cantidad de moles de cada uno, pero la suma total de moles se mantendrá constante. La cantidad de complejo producida se medirá, y el máximo de producto medido indicará la estequiometria de reacción de los dos reactivos.
La cantidad producida del complejo se puede medir a través absorción UV, el complejo absorbe entre las longitudes de onda 460 – 550 nm.
Materiales
- Bureta de 50 mL
- Soporte universal
- Pinza para bureta
- Cubetas para espectrometría
- Espectrómetro
- 11 tubos de ensayo pequeños
- 2 Beaker de 50 mL
- Botella lavadora con agua desionizada
- Tapones
Reactivos
- Solución de 2.5×10-4 M de Fe2+*
- Solución de 2.5×10-4 M de solución de 1,10 fenantrolina**
*Preparada con sulfato ferroso amonio. Para un litro de solución pesar 0.098 g de la sal hexahidratada y preparar en agua desionizada. Agregar tres gotas de acido sulfúrico concentrado para evitar la oxidación del hierro.
**para 1 litro de solución pesar 0.0459 g de 1,10 fenantrolina y disolver en agua desionizada, calentar suavemente sin dejar hervir si es necesario. Si la solución se torna oscura descartar. Acidificar con 3 gotas de ácido clorhídrico.
Procedimiento
Tiempo necesario: 50 minutos
Servir 30 mL de la solución de 2.5×10-4 M de Fe2+ y 40 mL de la solución de 2.5×10-4 M de 1,10 de fenantrolina en los beaker. Marcar cada beaker con su contenido.
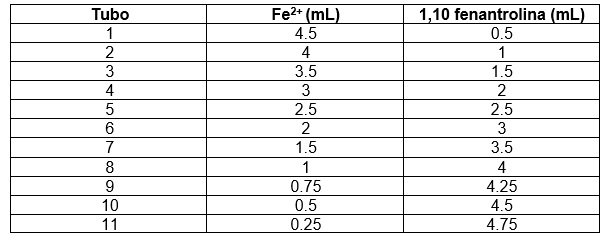
Realizar el montaje para bureta y prepararla para servir la solución de Fe2+. Lavar la bureta con agua desionizada y enjuagarla con un poco de solución de Fe2+. Marcar los tubos de ensayo con números del 1 al 11 y servir la cantidad necesaria de la solución en cada uno de ellos de acuerdo con la tabla.
Lavar la bureta con agua desionizada y enjuagarla con un poco de solución de 1,10 fenantrolina. Servir la cantidad indicada de la solución en cada tubo de ensayo según la tabla.
 Anuncio
AnuncioAgitar los tubos bien tapándolos e invirtiéndolos varias veces. El color rojo – naranja del complejo se desarrollará en un lapso de 10 minutos.
Enjuagar las dos cubetas para espectrometría con agua destilada y limpiar cuidadosamente con un paño suave y que no deje rastros. Llenar una de las cubetas con la solución de 1,10 fenantrolina, esta se usará como blanco para las mediciones.
Llenar la segunda cubeta con la solución del tubo #5, ajustar la absorbancia a cero empleando el blanco y leer la absorbancia de la mezcla #5 en el intervalo de 460 nm a 550 nm en intervalos de 10 nm. Determinar en que longitud de onda se observa mayor absorbancia y utilizarla para las siguientes observaciones. Devolver la solución a su tubo de ensayo y enjuagar la cubeta con agua desionizada.
Ajustar la longitud de onda a la obtenida en el paso anterior y recalibrar a cero empleando el blanco. No es necesario recalibrar entre medidas. Medir la absorbancia de cada una de las 11 soluciones preparadas enjuagando la cubeta de medición entre soluciones y secándola. Anotar los valores.
Anuncio
Después del experimento
Cálculos de la estequiometria de reacción
Graficar los valores empleando un programa de cálculo como Microsoft Excel ®, graficar volumen del ligando versus absorbancia. Se deben graficar de manera separada los valores ascendentes y los valores descendentes en una misma gráfica. Agregar líneas de tendencia a cada set de datos y determinar la ecuación lineal que mejor se ajuste a los datos. Hallar el punto de intersección de ambas líneas resolviendo las ecuaciones de manera simultánea. A partir de los volúmenes obtenidos, determinar la relación de volúmenes Fe2+: fenantrolina usando números enteros, lo que va a ser la relación estequiométrica para esta reacción.
¿Por qué se emplean unidades de volumen para determinar la cantidad a mezclar? ¿Es correcta esta aproximación? ¿en que casos no se podría realizar esta aproximación?
¿Por qué se emplea agua desionizada para la preparación de las soluciones y el enjuagado del material de vidrio? ¿Qué interferencias pueden presentarse en este experimento?
Recomendaciones de seguridad
Se deben manejar con cuidado las soluciones debido a su pH acido. La solución de 1,10 fenantrolina es irritante. En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la practica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información Reaction Stoichiometry and the Formation of a Metal Ion Complex (Experiment)
Clasificación
Nivel: Universitario
Tipo: Practica de enseñanza
Riesgo: medio
Como citar este artículo:
APA: (2018-10-17). Estequiometria de reacción de un complejo metálico. Recuperado de https://quimicafacil.net/manual-de-laboratorio/estequiometria-de-reaccion-de-un-complejo-metalico/
ACS: . Estequiometria de reacción de un complejo metálico. https://quimicafacil.net/manual-de-laboratorio/estequiometria-de-reaccion-de-un-complejo-metalico/. Fecha de consulta 2026-03-03.
IEEE: , "Estequiometria de reacción de un complejo metálico," https://quimicafacil.net/manual-de-laboratorio/estequiometria-de-reaccion-de-un-complejo-metalico/, fecha de consulta 2026-03-03.
Vancouver: . Estequiometria de reacción de un complejo metálico. [Internet]. 2018-10-17 [citado 2026-03-03]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/estequiometria-de-reaccion-de-un-complejo-metalico/.
MLA: . "Estequiometria de reacción de un complejo metálico." https://quimicafacil.net/manual-de-laboratorio/estequiometria-de-reaccion-de-un-complejo-metalico/. 2018-10-17. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net