Tiempo de lectura estimado: 5 minutos
Durante la electrólisis, las sustancias iónicas se descomponen en sustancias más simples cuando se hace pasar por ellas una corriente eléctrica. La electrólisis se utiliza para extraer y purificar metales.
Electrólisis de una solución
Las sustancias iónicas contienen partículas cargadas llamadas iones. Por ejemplo, el bromuro de plomo contiene iones de plomo cargados positivamente junto con iones de bromuro cargados negativamente.
La electrólisis es el proceso por el cual las sustancias iónicas se descomponen (se rompen) en sustancias más simples cuando se hace pasar una corriente eléctrica a través de ellas.
La electricidad es el flujo de electrones o iones. Para que la electrólisis funcione, el compuesto debe contener iones. Los compuestos covalentes no pueden actuar como electrolitos porque contienen átomos neutros.
Los iones deben tener libertad de movimiento, lo que es posible cuando una sustancia iónica se disuelve en agua o se funde. Por ejemplo, si se hace pasar electricidad a través de bromuro de plomo fundido, éste se descompone para formar plomo y bromo.
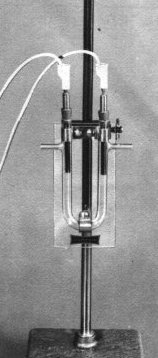
Materiales
- Tubo en U con tubos laterales
- Soporte universal
- Generador de corriente continua de 6 voltios
- Electrodos de grafito o Ni-Cr montados sobre tapones de goma
- Cables.
Reactivos
- Sol de yoduro de potasio 0,1 M
- Fenolftaleína 1 %
- Solución de almidón
Procedimiento – Electrólisis de una solución de yoduro de potasio
Vierta la solución de yoduro de potasio en el tubo en U hasta un nivel suficiente para sumergir los electrodos. Introduce los electrodos en los dos agujeros del tubo y conéctalos al generador de corriente continua, indicando el ánodo (+) y el cátodo (-).
En la solución, antes de la electrólisis, hay moléculas de H2O y los iones: K+ e I– procedentes de la disociación de la sal. Se desprecia la presencia de los iones H3O+ y OH– procedentes de la autoionización del agua.
Cerrando el circuito, el ánodo recupera aniones I– y moléculas de H2O, mientras que el cátodo recupera cationes K+ y moléculas de agua. Se sabe que las moléculas de agua son dipolos, por lo que pueden migrar a ambos electrodos.
Se producen las siguientes reacciones redox:
Cátodo: Se desarrollan burbujas de gas hidrógeno formadas por la reacción de reducción del agua:
No se produce la reducción simultánea del K+ a potasio elemental porque el potencial estándar de éste es: E0(K+/K) = -2,91 v, valor que indica una tendencia a adquirir electrones, es decir a reducirse, menor que la del agua (E0(H2O/H2) = – 0,83 v).
Tomamos una parte de la solución catódica a través del tubo pequeño y la ponemos en un tubo de ensayo; añadiendo unas gotas de fenolftaleína notaremos un pH básico debido al aumento de la concentración de OH– producido en la reacción de reducción.
Ánodo: se produce un lento depósito de yodo debido a la reacción de oxidación:
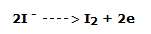
Sólo el ion I– se oxida; su potencial estándar (E0(2I–/I2) = +0,536 v) es, de hecho, inferior al del agua (E0(O2/H2O) = +1,23 v); esto significa que I – tiene una mayor tendencia a ceder electrones, es decir a oxidarse, que la del agua.
La reacción general es:
La presencia de yodo puede detectarse con unas gotas de tetracloruro de carbono o de benceno, que teñirán de color violeta, o con unas gotas de solución de almidón, que dará un color azul.
Después del laboratorio
Con base a la estequiometria de la reacción y a la corriente aplicada, calcular la cantidad teórica de iones yoduro que se obtienen en un minuto, dos minutos y cinco minutos de electrolisis
Proponga un método para cuantificar la cantidad de yodo obtenido en la electrolisis
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Para más información Electrolysis of potassium iodide solution
Como citar este artículo:
APA: (2021-06-09). Electrólisis de una solución de yoduro de potasio. Recuperado de https://quimicafacil.net/manual-de-laboratorio/electrolisis-de-una-solucion-de-yoduro-de-potasio/
ACS: . Electrólisis de una solución de yoduro de potasio. https://quimicafacil.net/manual-de-laboratorio/electrolisis-de-una-solucion-de-yoduro-de-potasio/. Fecha de consulta 2026-02-27.
IEEE: , "Electrólisis de una solución de yoduro de potasio," https://quimicafacil.net/manual-de-laboratorio/electrolisis-de-una-solucion-de-yoduro-de-potasio/, fecha de consulta 2026-02-27.
Vancouver: . Electrólisis de una solución de yoduro de potasio. [Internet]. 2021-06-09 [citado 2026-02-27]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/electrolisis-de-una-solucion-de-yoduro-de-potasio/.
MLA: . "Electrólisis de una solución de yoduro de potasio." https://quimicafacil.net/manual-de-laboratorio/electrolisis-de-una-solucion-de-yoduro-de-potasio/. 2021-06-09. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net