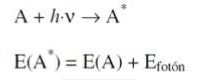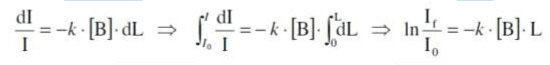Tiempo de lectura estimado: 7 minutos
Una bebida energizante contiene una alta concentración de cafeína que puede ser determinada empleando un método espectrofotométrico. La espectrofotometría es una de las técnicas instrumentales más utilizadas para la detección específica de compuestos.
Se caracteriza por su precisión, sensibilidad y su aplicabilidad a moléculas de distinta clase y en diferentes estados de agregación. Los fundamentos físicos y químicos de la espectrofotometría son relativamente sencillos y sirven para introducir los elementos básicos del análisis instrumental.
Espectrofotometría
Las moléculas pueden absorber energía luminosa y almacenarla en forma de energía interna. La Mecánica Cuántica indica que la luz está compuesta de fotones cada uno de los cuáles tiene una energía según la siguiente ecuación:
donde c es la velocidad de la luz, ν es su frecuencia, λ su longitud de onda y h= 6.6 * 10-34 J×s es la constante de Planck. Cuando decimos que una sustancia química absorbe luz de longitud de onda l, esto significa que las moléculas de esa sustancia absorben fotones de esa longitud de onda.
En la técnica de espectroscopia UV-vis, se emplea la absorción de luz en el ultravioleta cercano (λ = 325-420 nm) y en el visible (λ = 420-900 nm). Cuando una molécula absorbe un fotón en este intervalo espectral, se excita pasando un electrón de un orbital del estado fundamental a un orbital excitado de energía superior. De esta manera la molécula almacena la energía del fotón:
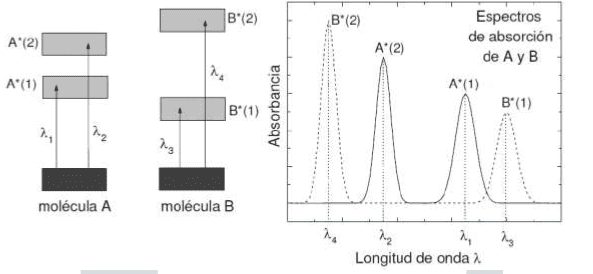
Como la energía se conserva, la diferencia de energía entre el estado fundamental de la molécula (A) y su estado excitado (A*) debe ser exactamente igual a la energía del fotón. Es decir, una molécula sólo puede absorber fotones cuya energía h×n sea igual a la energía de un estado molecular excitado. Cada molécula tiene una serie de estados excitados discretos (o bandas) que dependen de su estructura electrónica y que la distinguen del resto de moléculas. Como consecuencia, el espectro de absorción, es decir, la luz absorbida en función de la longitud de onda constituye una verdadera representación de identidad de cada sustancia o molécula.
También es posible analizar una mezcla de dos compuestos midiendo su espectro de ultravioleta/visible y cuantificar la concentración de uno o de ambos. Cuando dos o más sustancias aparecen mezcladas en una misma muestra sus espectros de absorción aparecen superpuestos:
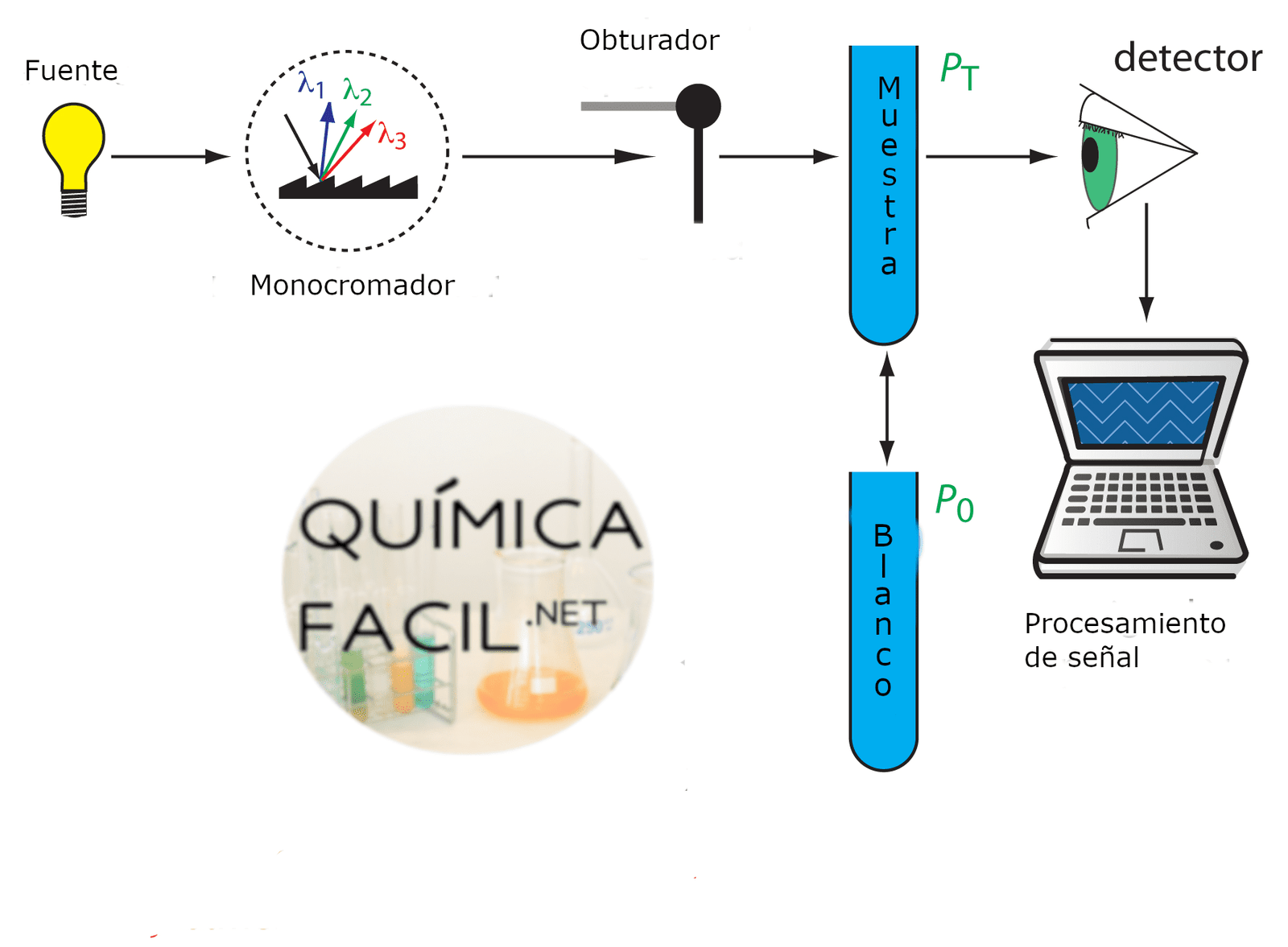
Los espectros de absorción se miden mediante un instrumento denominado espectrómetro. Estos instrumentos constan de una fuente de luz “blanca” caracterizada por un espectro de emisión continuo en un intervalo amplio de longitudes de onda (por ejemplo 325 nm – 900 nm) y de un monocromador que actúa como filtro óptico transmitiendo un haz de luz de longitud de onda fija λ e intensidad I0. Este haz de luz traspasa la cubeta de análisis donde se encuentra la muestra a analizar. Un detector sensible a la luz mide la intensidad del haz a la salida.
La intensidad del haz de luz se va atenuando a medida que atraviesa la muestra debido a la absorción de las moléculas de la muestra. El ritmo de absorción depende de la intensidad inicial de luz y de la concentración de moléculas. De esta manera, cuando un haz de luz de intensidad I recorre una distancia dL en una muestra con una concentración de moléculas [B], se produce una atenuación de intensidad dI dada por:
La constante k se denomina coeficiente de absortividad molar. La expresión anterior se puede integrar de la siguiente forma:
lo cual da lugar a la ley de Beer-Lambert para la absorción que relaciona la intensidad a la salida y la muestra If, con la intensidad inicial I0, la concentración de moléculas y la distancia recorrida por la luz en la muestra, L.
El espectrofotómetro, en lugar de la intensidad, mide la absorbancia A que se define por:
La utilización de la absorbancia al realizar los espectros tiene la ventaja de ser directamente proporcional a la concentración de moléculas en la muestra.
Materiales
- Balón aforado de 100 mL
- 6 balones aforados de 25 mL
- Pipeta aforada de 1 mL
- Pipeta aforada de 5 mL
- Propipeta o pipeteador
- Vidrio de reloj
- Cubeta para espectroscopia UV-vis
- Equipo de UV-vis
- Balanza analítica
Reactivos
- Cafeína grado analítico
- Agua destilada
- Bebida energizante con alto contenido en cafeína
Procedimiento
Máximo de absorción de cafeína
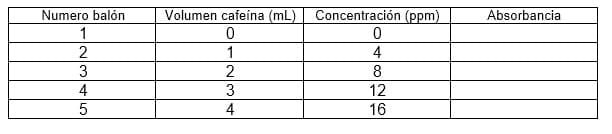
Preparar una solución patrón con concentración de 100 ppm de cafeína empleando el balón aforado de 100 mL. De la muestra patrón y empleando la pipeta aforada, tomar el volumen de solución de cafeína según la tabla siguiente y colocarlo en cada balón aforado de 25 mL. Llevar a volumen con agua destilada
Tomar el espectro UV-vis de la solución más diluida (balón 2) y determinar la longitud de onda a la cual se observa el máximo de absorción. Utilizar dicha longitud de onda para determinar la absorción de las demás soluciones empleando el balón 1 como blanco. Recuerde enjuagar la cubeta con agua destilada entre mediciones. Realizar una curva de calibración con los datos obtenidos empleando un software de hoja de cálculo como por ejemplo Excel ® ajustando los datos con una técnica de ajuste como mínimos cuadrados.
Medición del contenido de cafeína en una bebida energizante
Tomar 5 mL de la bebida energizante y llevar a un balón aforado de 25 mL, llevar a volumen con agua destilada.
Tomar el espectro UV-vis y determinar la absorbancia a la longitud de onda de trabajo. Empleando la curva de calibración elaborada, determinar la concentración de la cafeína en la muestra problema.
Después del experimento
Comparar la longitud de onda de absorción de cafeína obtenida en la practica con la reportada en la literatura. En caso de no ser la misma longitud ¿Por qué existe esa diferencia?
La cafeína en la bebida energizante no fue purificada previamente antes de su medición, ¿Cómo puede ser afectada la medición del contenido de cafeína por la presencia de otros compuestos que generan interferencia en la medición? ¿Cómo se podría purificar la cafeína antes de la medición?
Recomendaciones de seguridad
Se debe leer el manual de operación del espectrómetro UV-vis a emplear, o recibir instrucción sobre su correcto manejo por parte de personal experto.
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Mayor información
Clasificación
Nivel: Universitario
Tipo: Practica de enseñanza
Riesgo: medio
Como citar este artículo:
APA: (2019-08-28). Determinación de cafeína en una bebida energizante empleando espectroscopia de absorción UV-vis. Recuperado de https://quimicafacil.net/manual-de-laboratorio/bebida-energizante/
ACS: . Determinación de cafeína en una bebida energizante empleando espectroscopia de absorción UV-vis. https://quimicafacil.net/manual-de-laboratorio/bebida-energizante/. Fecha de consulta 2026-02-17.
IEEE: , "Determinación de cafeína en una bebida energizante empleando espectroscopia de absorción UV-vis," https://quimicafacil.net/manual-de-laboratorio/bebida-energizante/, fecha de consulta 2026-02-17.
Vancouver: . Determinación de cafeína en una bebida energizante empleando espectroscopia de absorción UV-vis. [Internet]. 2019-08-28 [citado 2026-02-17]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/bebida-energizante/.
MLA: . "Determinación de cafeína en una bebida energizante empleando espectroscopia de absorción UV-vis." https://quimicafacil.net/manual-de-laboratorio/bebida-energizante/. 2019-08-28. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net