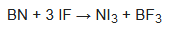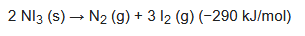Tiempo de lectura estimado: 8 minutos
El triyoduro de nitrógeno es un compuesto inorgánico con la fórmula NI3. Es un explosivo de contacto extremadamente sensible: pequeñas cantidades explotan con un chasquido fuerte y agudo cuando se tocan incluso ligeramente, liberando una nube púrpura de vapor de yodo; incluso puede ser detonado por radiación alfa. El NI3 tiene una compleja química estructural que es difícil de estudiar debido a la inestabilidad de los derivados.
La potencia del triyoduro de nitrógeno
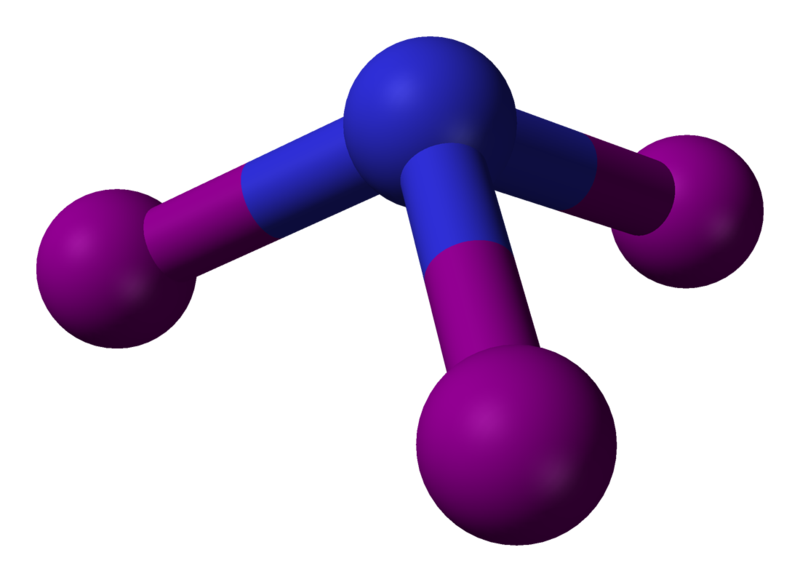
En el triyoduro de nitrógeno, debido a la estructura de las capas de electrones de nitrógeno, los tres átomos de yodo se unen a un lado del átomo de nitrógeno. Como los átomos de yodo tienen aproximadamente el doble del tamaño del nitrógeno, no «encajan» bien en el espacio limitado, y esto crea lo que se denomina «tensión estérica»: los átomos de yodo se repelen entre sí y, por lo tanto, sólo se unen muy ligeramente al átomo central de nitrógeno.
Se trata de una configuración de alta energía, cuya energía puede reducirse drásticamente reorganizando los átomos en una muestra de NI3, de modo que los átomos de nitrógeno se enlazan entre sí para formar gas nitrógeno (N2) y yodo elemental. Esto deja mucha energía sobrante, de ahí el golpe. La nube de púrpura es el yodo que se escapa de la reacción.
El NI3 es apenas estable. Si se mantiene aislado de toda forma de perturbación, permanecerá en esa forma, pero la aplicación de sólo una minúscula cantidad de energía de activación de casi cualquier tipo hará que algunas moléculas se rompan, liberando energía que desencadenará la ruptura de las moléculas adyacentes en una reacción en cadena hasta que toda la muestra haya detonado. La detonación procede a la velocidad del sonido en el material, que es del orden de 3 kilómetros por segundo.
La energía de activación es tan pequeña que el NI3 puede ser detonado por casi cualquier cosa: el cosquilleo de una pluma, el impacto de un globo, una corriente de aire, el aterrizaje de un insecto sobre él o un fuerte ruido. Incluso puede ser activado por una partícula alfa emitida por una fuente de radiación, es el único explosivo conocido que es tan sensible. En la práctica, en el mundo real, a veces simplemente explota y no se sabe por qué.
Cuando se sintetiza el NI3, se precipita de la solución de hidróxido de amonio y se puede separar por filtración. Inicialmente se mantendrá húmedo por la solución y, mientras esté húmedo, es relativamente estable, especialmente si se mantiene frío y en la oscuridad (pero eso es «relativamente»: con este material nunca se sabe). Sólo cuando se seca se vuelve hipersensible.
El NI3 no tiene ninguna aplicación práctica. Es tan sensible que siempre explotará de cualquier manipulación. Una vez que se seca, no puede ser movido sin que se explote. Para ser útil, un explosivo debe tener una energía de activación lo suficientemente alta como para que sólo pueda ser activado por un estímulo que puedas controlar, como el percutor de un arma de fuego, el calor o la electricidad. No hay riesgo de que terroristas usen el triyoduro de nitrógeno porque cualquiera que lo fabricara en cantidades suficientes para hacer un daño serio sólo conseguiría volarse a sí mismo
Una familia explosiva
Aunque el triyoduro de nitrógeno es el más conocido de la familia, su relación con el tricloruro de nitrógeno es aún más sensible, con una tendencia a explotar tanto por exposición a la luz solar como por contacto.
Se cree que la explosión que cegó temporalmente a Humphrey Davy fue causada por esta sustancia. Davy llamó a un joven inculto, que había sido visto tomando notas detalladas en sus conferencias, para que actuara como secretario mientras el científico estaba cegado. El joven fue enviado lejos después de su corto período de trabajo, pero finalmente regresó a la Royal Institution – su nombre era Michael Faraday.
Video de la explosión de triyoduro de nitrógeno en cámara lenta (Gracias al Royal Institution)
Davy estaba siguiendo el trabajo del químico francés Pierre Dulong, que aisló el tricloruro de nitrógeno, pero perdió tres dedos y un ojo por su inestabilidad. El trifluoruro de nitrógeno, por el contrario, es estable, en parte porque, a diferencia de las otras moléculas de la familia, presenta un átomo de flúor lo suficientemente pequeño como para que no se apiñe demasiado al colocar tres de ellas alrededor de un átomo de nitrógeno compacto.
La estructura del NI3 y sus derivados
El triyoduro de nitrógeno se caracterizó por primera vez mediante la espectroscopia Raman en 1990, cuando se preparó por una ruta libre de amoníaco. El nitruro de boro reacciona con el monofluoruro de yodo en el triclorofluorometano a -30 °C para producir NI3 puro de bajo rendimiento:
El NI3 es piramidal (simetría molecular C3v), al igual que los otros trihaluros de nitrógeno y el amoníaco.
El material que suele denominarse «triyoduro de nitrógeno» se prepara mediante la reacción del yodo con el amoníaco. Cuando esta reacción se lleva a cabo a bajas temperaturas en amoníaco anhidro, el producto inicial es NI3 – (NH3)5, pero este material pierde algo de amoníaco al calentarse para dar el aducto 1:1 NI3 – NH3. Este aducto fue reportado por primera vez por Bernard Courtois en 1812, y su fórmula fue finalmente determinada en 1905 por Oswald Silberrad.
Su estructura de estado sólido consiste en cadenas de (-NI2-I-NI2-I-NI2-I-) Las moléculas de amoníaco están situadas entre las cadenas. Cuando se mantienen frías en la oscuridad y húmedas con amoníaco, el -NI3 – NH3 es estable.
Descomposición y explosividad
La inestabilidad del NI3 y del NI3 – NH3 puede atribuirse a la gran tensión estérica causada por los tres grandes átomos de yodo que se mantienen en proximidad unos de otros alrededor del relativamente pequeño átomo de nitrógeno. Esto da como resultado una energía de activación muy baja para su descomposición, una reacción que se hace aún más favorable debido a la gran estabilidad del N2.
El triyoduro de nitrógeno no tiene un valor comercial práctico debido a su extrema sensibilidad a los choques, lo que hace imposible su almacenamiento, transporte y utilización para explosiones controladas. Mientras que la nitroglicerina pura es también muy sensible a los choques (aunque no tanto como el triyoduro de nitrógeno, que puede activarse con el toque de una pluma) y potente, sólo gracias a los flematizadores se redujo su sensibilidad a los choques y se hizo más seguro manejarla y transportarla en forma de dinamita.
La descomposición del NI3 procede de la siguiente manera para dar gas nitrógeno y yodo:
Sin embargo, el material seco es un explosivo de contacto, que se descompone aproximadamente de la siguiente manera:
De acuerdo con esta ecuación, estas explosiones dejan manchas de color naranja a púrpura de yodo, que pueden ser eliminadas con una solución de tiosulfato de sodio. Un método alternativo para eliminar las manchas es simplemente dejar que el yodo se sublime. A veces se sintetizan pequeñas cantidades de triyoduro de nitrógeno como demostración para los estudiantes de química de la escuela secundaria o como un acto de «magia química».
Para resaltar la sensibilidad del compuesto, normalmente se detona al tocarlo con una pluma, pero incluso la más mínima corriente de aire, la luz láser u otro movimiento puede causar la detonación. El triyoduro de nitrógeno también es notable por ser el único explosivo químico conocido que detona cuando se expone a partículas alfa y productos de fisión nuclear.
Para más información Nitrogen triiodide
Como citar este artículo:
APA: (2021-10-12). Triyoduro de nitrógeno. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/triyoduro-de-nitrogeno/
ACS: . Triyoduro de nitrógeno. https://quimicafacil.net/compuesto-de-la-semana/triyoduro-de-nitrogeno/. Fecha de consulta 2026-02-27.
IEEE: , "Triyoduro de nitrógeno," https://quimicafacil.net/compuesto-de-la-semana/triyoduro-de-nitrogeno/, fecha de consulta 2026-02-27.
Vancouver: . Triyoduro de nitrógeno. [Internet]. 2021-10-12 [citado 2026-02-27]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/triyoduro-de-nitrogeno/.
MLA: . "Triyoduro de nitrógeno." https://quimicafacil.net/compuesto-de-la-semana/triyoduro-de-nitrogeno/. 2021-10-12. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net