Actualizado en julio 29, 2021
Tiempo de lectura estimado: 10 minutos
El ácido mágico (FSO3H-SbF5) es un superácido que consiste en una mezcla, más comúnmente en una proporción de 1:1 molar, de ácido fluorosulfúrico (HSO3F) y pentafluoruro de antimonio (SbF5).
Este sistema conjugado de superácidos de Brønsted-Lewis fue desarrollado en el decenio de 1960 por el laboratorio George Olah de la Universidad Case Western Reserve, y se ha utilizado para estabilizar los carbocationes y los iones de carbono hipercoordinados en medios líquidos.
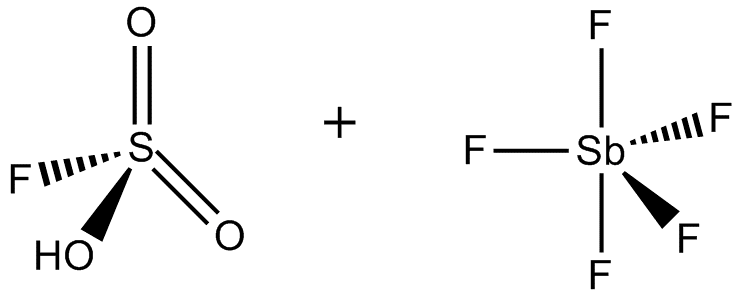
El ácido mágico y otros superácidos también se utilizan para catalizar la isomerización de hidrocarburos saturados, y se ha demostrado que protonan incluso bases débiles, como el metano, el xenón, los halógenos y el hidrógeno molecular.
Historia del ácido mágico
El sistema de ácido mágico fue desarrollado en la década de 1960 por George Olah, e iba a ser utilizado para estudiar carbocationes estables. Gillespie también utilizó el sistema de ácido para generar cationes inorgánicos con deficiencia de electrones.
El nombre se originó después de una fiesta de Navidad en 1966, cuando un miembro del laboratorio de Olah colocó una vela de parafina en el ácido, y encontró que se disolvía bastante rápido.
El examen de la solución con 1H-NMR mostró un catión tert-butilo, lo que sugiere que la cadena de parafina que forma la cera se había cortado, y luego se isomerizó en el carbocatión terciario relativamente estable. El nombre apareció en un artículo publicado por el laboratorio de Olah.
Propiedades químicas del ácido mágico
Aunque una proporción molar de 1:1 de HSO3F y SbF5 es la que mejor genera iones de carbono, los efectos del sistema en otras proporciones molares también han sido documentados.
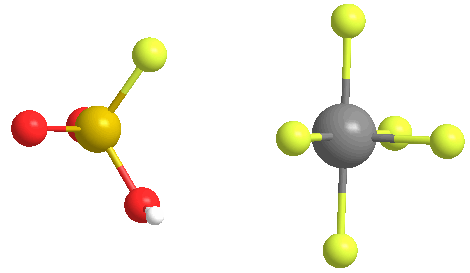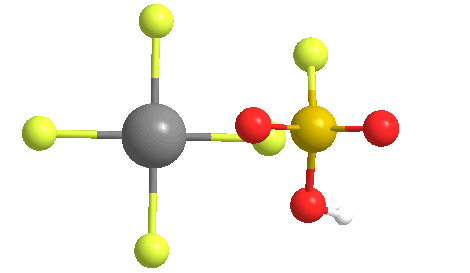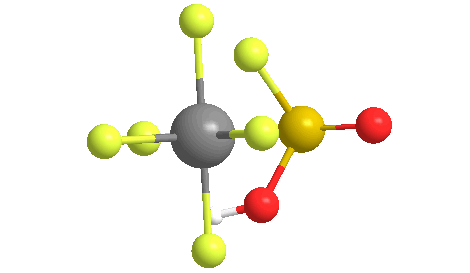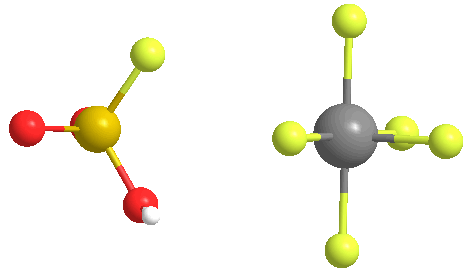
Cuando la relación SbF5:HSO3F es inferior a 0,2, los dos equilibrios siguientes, determinados por la espectroscopia de RMN 19F, son los más destacados en la solución:

En ambas estructuras, el azufre tiene una coordinación tetraédrica, no plana. Los dobles enlaces entre el azufre y el oxígeno se representan más adecuadamente como enlaces simples, con cargas formales negativas en los átomos de oxígeno y una carga formal más dos en el azufre. Los átomos de antimonio también tendrán una carga formal de menos uno.
En la figura anterior, el Equilibrio I representa el 80% de los datos de RMN, mientras que el Equilibrio II representa alrededor del 20%. A medida que la proporción de los dos compuestos aumenta de 0,4 a 1,4, aparecen nuevas señales de RMN y aumentan su intensidad con el incremento de las concentraciones de SbF5. La resolución de las señales también disminuye, debido al aumento de la viscosidad del sistema líquido
Todos los ácidos productores de protones más fuertes que el ácido sulfúrico al 100% se consideran superácidos, y se caracterizan por valores bajos de la función de acidez de Hammett.
Por ejemplo, el ácido sulfúrico, H2SO4, tiene una función de acidez Hammett, H0, de -12, el ácido perclórico, HClO4, tiene una función de acidez Hammett, de -13, y la del sistema de ácido mágico 1:1, HSO3F-SbF5, es de -23. Se cree que el ácido fluorantimónico, el superácido más fuerte que se conoce, alcanza valores H0 extrapolados hasta -28.

Usos del ácido mágico
Observaciones de carbocationes estables
El ácido mágico tiene una baja nucleofilia, lo que permite una mayor estabilidad de los carbocationes en solución. El carbocatión trivalente «clásico» puede observarse en el medio ácido, y se ha comprobado que es planar y sp2-híbrido.
Debido a que el carbono está rodeado por sólo seis electrones de valencia, es altamente deficiente en electrones y electrofílico. Se describe fácilmente por las estructuras de puntos de Lewis porque contiene sólo dos electrones, dos enlaces de carbono. Muchos cationes cicloalquílicos terciarios también pueden formarse en soluciones superácidas.
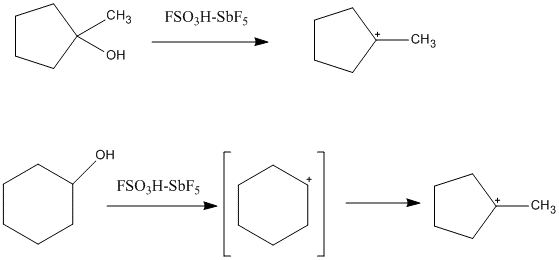
Un ejemplo de ello es el catión 1-metil-1-ciclopentil, que se forma a partir del precursor del ciclopentano y del ciclohexano. En el caso del ciclohexano, el catión ciclopentil se forma a partir de la isomerización del carbocatión secundario al carbocatión terciario, más estable. También se han observado iones de ciclopropilcarbenio, cationes de alkenilo y cationes de arenio.
Sin embargo, a medida que se generalizó el uso del sistema de ácido mágico, se observaron carbocationes de mayor coordinación. Los carbocationes pentacoordinados, también descritos como iones no clásicos, no pueden representarse usando sólo dos electrones, enlaces de dos centros, y requieren, en cambio, dos electrones, tres (o más) enlaces de centros.
En estos iones, dos electrones se deslocalizan sobre más de dos átomos, haciendo que estos centros de enlace sean tan deficientes en electrones que permiten a los alcanos saturados participar en reacciones electrofílicas. El descubrimiento de los carbocationes hipercoordinados alimentó la controversia sobre los iones no clásicos de los años 50 y 60.
Debido a la lenta escala de tiempo del 1H-NMR, las cargas positivas de rápido equilibrio en los átomos de hidrógeno probablemente pasarían desapercibidas. Sin embargo, la espectroscopia IR, la espectroscopia Raman y la RMN 13C se han utilizado para investigar los sistemas de carbocatión puente. Un catión controvertido, el catión norbital, se ha observado en varios medios, entre ellos el ácido mágico.

El átomo de carbono metileno puente está pentacoordinado, con tres enlaces de dos electrones y dos centros, y un enlace de dos electrones y tres centros con su restante orbital sp3. Los cálculos de la mecánica cuántica también han demostrado que el modelo clásico no es un mínimo de energía.
Reacciones con alcanos
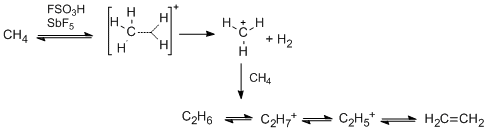
El ácido mágico es capaz de protonar alcanos. Por ejemplo, el metano reacciona para formar el CH+5 a 140 °C y a presión atmosférica, aunque algunos iones de hidrocarburos de mayor peso molecular también se forman como subproductos. El gas de hidrógeno es otro subproducto de la reacción.
En presencia de FSO3D en lugar de FSO3H, se ha demostrado que el metano intercambia átomos de hidrógeno por átomos de deuterio, y se libera HD en lugar de H2.
Esta es una evidencia que sugiere que, en estas reacciones, el metano es de hecho una base, y puede aceptar un protón del medio ácido para formar CH+5. Este ión es entonces deprotoneado, explicando el intercambio de hidrógeno, o pierde una molécula de hidrógeno para formar CH+3 – el ión de carbono. Esta especie es bastante reactiva, y puede producir varios carbocationes nuevos, como se muestra a continuación.
Los alcanos más grandes, como el etano, también son reactivos en el ácido mágico, y ambos intercambian átomos de hidrógeno y se condensan para formar carbocationes más grandes, como el neopentano protonado. Este ión es entonces hendido a temperaturas más altas, y reacciona para liberar gas de hidrógeno y formar el catión t-amil a temperaturas más bajas.

Es en esta nota que George Olah sugiere que ya no tomemos como sinónimo los nombres «alcano» y «parafina». La palabra «parafina» se deriva del latín «parum affinis», que significa «falta de afinidad». Dice: «Sin embargo, hacemos esta recomendación con cierta nostalgia, ya que los ‘gases inertes’ al menos mantuvieron su ‘nobleza’ al hacerse evidente su reactividad química, pero referirse a los ‘hidrocarburos nobles’ parecería inapropiado».
Catálisis con hidroperóxidos
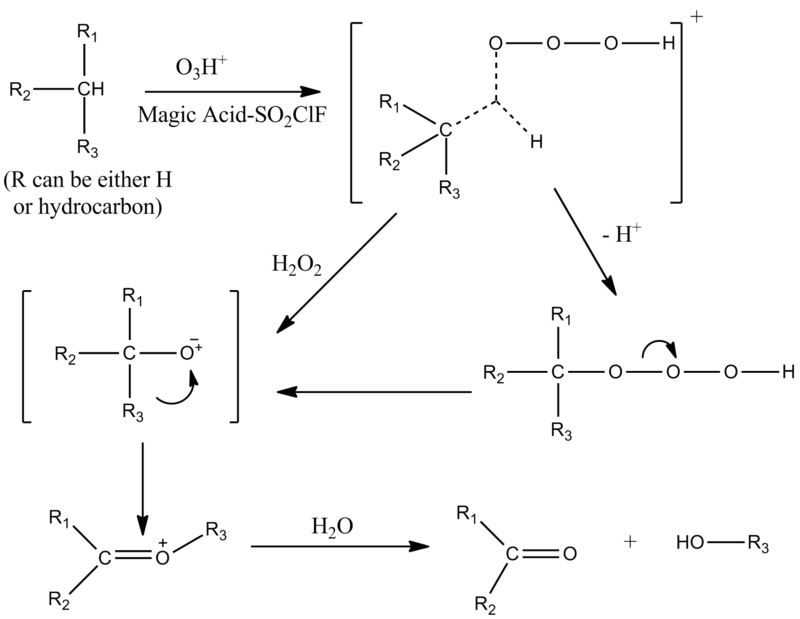
El ácido mágico cataliza las reacciones de división de los hidroperóxidos y los alcoholes terciarios. La naturaleza de los experimentos para determinar el mecanismo, a saber, el hecho de que se produjeron en un medio superácido, permitió observar los intermediarios de carbocation formados. Se determinó que el mecanismo depende de la cantidad de ácido mágico utilizado.
Cerca de la equivalencia molar, sólo se observa la división O-O, pero con el creciente exceso de ácido mágico, la división C-O compite con la división O-O. El exceso de ácido probablemente desactiva el peróxido de hidrógeno formado en la heterólisis C-O.

El ácido mágico también cataliza la hidroxilación electrofílica de los compuestos aromáticos con peróxido de hidrógeno, lo que da lugar a una preparación de alto rendimiento de productos monohidroxilados. Los fenoles existen como especies completamente protonadas en soluciones superácidas, y cuando se producen en la reacción, se desactivan hacia un ataque electrofílico posterior. El peróxido de hidrógeno protonado es el agente hidroxilante activo.
Catálisis con ozono
La oxigenación de los alcanos puede ser catalizada por una solución mágica de ácido-SO2ClF en presencia de ozono. El mecanismo es similar al de la protólisis de los alcanos, con una inserción electrofílica en los enlaces individuales σ del alcano. El estado de transición complejo de hidrocarburo-ozono tiene la forma de un ión coordinado pentagonalmente.
Los alcoholes, cetonas y aldehídos también se oxigenan por inserción electrofílica.
Recomendaciones de seguridad
Como con todos los ácidos fuertes, y especialmente los superácidos, se debe usar el equipo de protección personal adecuado. Además de los guantes y gafas protectoras obligatorios, se recomienda el uso de una pantalla facial y un respirador de cara completa.
Como era de esperar, el ácido mágico es altamente tóxico por ingestión e inhalación, causa graves quemaduras en la piel y los ojos, y es tóxico para la vida acuática.
Para más información Superacid Chemistry
Como citar este artículo:
APA: (2020-08-18). Ácido mágico. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/acido-magico/
ACS: . Ácido mágico. https://quimicafacil.net/compuesto-de-la-semana/acido-magico/. Fecha de consulta 2024-07-27.
IEEE: , "Ácido mágico," https://quimicafacil.net/compuesto-de-la-semana/acido-magico/, fecha de consulta 2024-07-27.
Vancouver: . Ácido mágico. [Internet]. 2020-08-18 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/acido-magico/.
MLA: . "Ácido mágico." https://quimicafacil.net/compuesto-de-la-semana/acido-magico/. 2020-08-18. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net