Tiempo de lectura estimado: 8 minutos
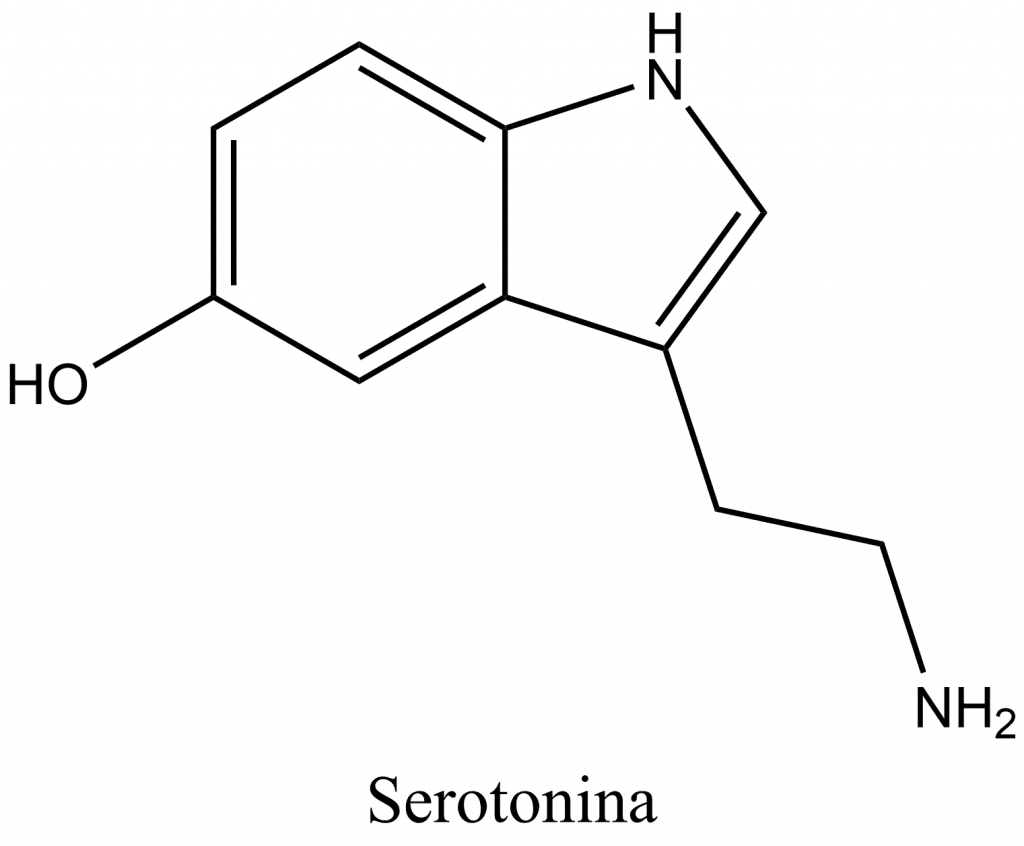
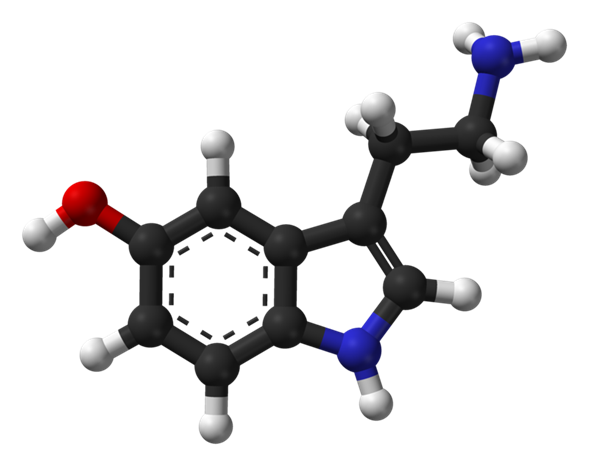
La serotonina o 5-hidroxitriptamina (5-HT) es un neurotransmisor de tipo monoamina. Su función biológica es compleja y polifacética, modulando el estado de ánimo, la cognición, la recompensa, el aprendizaje, la memoria y numerosos procesos fisiológicos como el vómito y la vasoconstricción.
Desde el punto de vista bioquímico, la molécula de indolamina se deriva del aminoácido triptófano, a través de la hidroxilación (limitante) de la posición 5 del anillo (formando el intermediario 5-hidroxitriptófano), y luego la descarboxilación para producir serotonina. La serotonina se encuentra principalmente en el sistema nervioso entérico situado en el tracto gastrointestinal (tracto GI).
Sin embargo, también se produce en el sistema nervioso central (SNC), concretamente en los núcleos del rafe situados en el tronco cerebral, en las células de Merkel situadas en la piel, en las células neuroendocrinas pulmonares y en las células receptoras del gusto en la lengua. Además, la serotonina se almacena en las plaquetas de la sangre y se libera durante la agitación y la vasoconstricción, donde actúa como agonista de otras plaquetas.
Historia y origen del nombre
En 1935, el italiano Vittorio Erspamer demostró que un extracto de células enterocromafines hacía que los intestinos se contrajeran. Algunos creyeron que contenía adrenalina, pero dos años más tarde, Erspamer pudo demostrar que se trataba de una amina desconocida hasta entonces, a la que denominó «enteramina». En 1948, Maurice M. Rapport, Arda Green e Irvine Page, de la Clínica Cleveland, descubrieron una sustancia vasoconstrictora en el suero sanguíneo, y como era un agente sérico que afectaba al tono vascular, la denominaron serotonina.

En 1952, se demostró que la enteramina era la misma sustancia que la serotonina, y a medida que se dilucidaba la amplia gama de funciones fisiológicas, la abreviatura 5-HT del nombre químico propio 5-hidroxitriptamina se convirtió en el nombre preferido en el campo farmacológico. Los sinónimos de la serotonina incluyen: 5-hidroxitriptamina, trombotina, enteramina, sustancia DS y 3-(β-Aminoethyl)-5-hidroxiindol. En 1953, Betty Twarog y Page descubrieron la serotonina en el sistema nervioso central. Page consideró que los trabajos de Erspamer en Octopus vulgaris, Discoglossus pictus, Hexaplex trunculus y Bolinus brandaris eran válidos y fundamentales para entender esta sustancia recién identificada, pero consideró que sus resultados anteriores en varios modelos -especialmente los de la sangre de rata- estaban demasiado confundidos por la presencia de otros MA, incluidos algunos otros vasoactivos.
Química de la serotonina
La serotonina, al igual que la triptamina, pertenece al grupo de las indolaminas o triptaminas. La serotonina es una base débil debido a su grupo amino alifático primario. Su constante ácida pKS de 10,4 es comparable a la de la triptamina. Por lo tanto, en condiciones fisiológicas, la serotonina existe en una forma predominantemente protonada. En su forma protonada, la serotonina es capaz de producir fluorescencia. Esta propiedad también se utiliza para su detección. El máximo de absorción está en 309 nm y el de emisión en 336 nm.
Rutas de síntesis
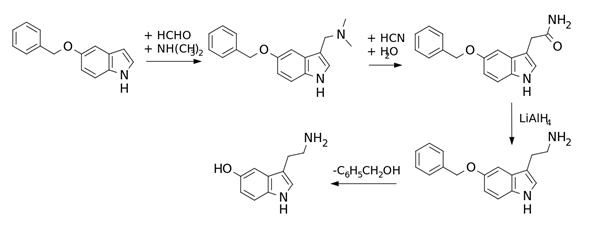
Se han descrito numerosas vías para la producción sintética de serotonina. Las estrategias básicas de la síntesis de la serotonina incluyen, en particular, la adición del componente β-etilamina al cuerpo de indol, la hidroxilación de la triptamina y la síntesis de una columna vertebral de indol a partir de varios sistemas precursores posibles.
Las rutas sintéticas basadas en la introducción de la fracción de β-etilamina comienzan con el 5-hidroxiindol, cuyo grupo hidroxi está protegido preferentemente con un grupo bencílico o, más raramente, con un grupo metilo. El primero se escinde hidrogenolíticamente, el segundo preferentemente con tribromuro de boro. La primera síntesis de laboratorio, llevada a cabo en 1951 por Hamlin y Fischer, utiliza la reacción de Mannich para producir la gramina correspondiente en un primer paso de la síntesis, que luego se hace reaccionar con cianuro en alcohol acuoso para la extensión de la cadena y la posterior hidrólisis a la 5-benciloxindol-3-acetamida. Tras la reducción de la amida y la posterior escisión del éter, se puede aislar la serotonina.
Según una publicación casi contemporánea de Merrill E. Speeter y colaboradores, el yoduro de magnesio 3-(5-benciloxi)indolilo se prepara primero como reactivo de Grignard y luego se hace reaccionar con cloroacetonitrilo para formar el correspondiente 3-acetonitrilindo. El nitrilo se reduce y el éter se escinde.
Una variante relacionada con los procedimientos anteriores con rendimientos mejorados describe la preparación de [11C]-serotonina radiomarcada para investigaciones de tomografía por emisión de positrones. En este proceso, la 5-metoxigramina se hace reaccionar en N2 para formar el compuesto de amonio cuaternario y se sustituye nucleófilamente con [11C]-cianhídrido para formar 5-metoxi-3-acetonitrilindol.
Un método que se limita a dos pasos de reacción consiste en la adición de nitroetileno al 5-benciloxindol con la subsiguiente hidrogenación. El nitrovinilindol, que aparece como intermedio, es accesible alternativamente a través de una condensación aldólica del indol-3-carbaldehído con nitrometano. Además, también existe la ruta probada a través de la acilación de Friedel-Crafts con cloruro de oxalilo. El cloruro de 5-benciloxi-3-indole-gloxil obtenido de este modo se combina con la dibencilamina para formar la amida, que se reduce y desbenzila. Otra estrategia de síntesis se basa en el uso del nitrometano.
Otra estrategia sintética se basa en la hidroxilación de la triptamina a serotonina. Tras proteger la función amina a la N-metoxicarboniltriptamina, ésta se reduce con trietilsilano a la correspondiente indolina. La oxidación de ésta con peróxido de hidrógeno en presencia de tungstato de sodio dihidratado forma el intermedio 1-hidroxi-N-metoxicarboniltriptamina. La hidroxilación nucleofílica regioselectiva en la posición 5 tiene éxito con un 85% de ácido fórmico. Los pasos finales de hidrólisis, como la desprotección alcalina, producen la serotonina.
Otro método de producción se basa en la síntesis de indoles como paso final. El 2,5-Dimetoxibenzaldehído se somete a la reacción de Knoevenagel con cianoacetato y se añade ácido cianhídrico al aceptor Michael resultante. El compuesto de succinonitrilo se convierte por hidrogenación y escisión de éter en 1,4-diamino-2-(2,5-dihidroxifenil)butano, que luego se convierte oxidativamente con ferricianuro en el producto final. Es probable que este último paso se realice a través de la quinona, que se condensa intramolecularmente en la imina y se aromatiza en el indol.
Biosíntesis
En los animales, incluido el ser humano, la serotonina se sintetiza a partir del aminoácido L-triptófano mediante una corta vía metabólica que consta de dos enzimas, la triptófano hidroxilasa (TPH) y la aminoácido aromático descarboxilasa (DDC), y la coenzima piridoxal fosfato. La reacción mediada por la TPH es el paso que limita la velocidad en la vía. Se ha demostrado que la TPH existe en dos formas: TPH1, que se encuentra en varios tejidos, y TPH2, que es una isoforma específica de las neuronas.
La serotonina puede sintetizarse a partir del triptófano en el laboratorio utilizando Aspergillus niger y Psilocybe coprophila como catalizadores. La primera fase hasta el 5-hidroxitriptófano requeriría dejar reposar el triptófano en etanol y agua durante 7 días, luego mezclar en suficiente HCl (u otro ácido) para llevar el pH a 3, y luego añadir NaOH para hacer un pH de 13 durante 1 hora.
El Asperigillus niger sería el catalizador de esta primera fase. La segunda fase para sintetizar triptófano propiamente dicho a partir del intermedio 5-hidroxitriptófano requeriría añadir etanol y agua, y dejar reposar durante 30 días esta vez. Los dos pasos siguientes serían los mismos que en la primera fase: añadir HCl para hacer que el pH sea = 3, y luego añadir NaOH para hacer que el pH sea muy básico a 13 durante 1 hora. En esta fase se utiliza la Psilocybe coprophila como catalizador de la reacción.
La serotonina tomada por vía oral no pasa a las vías serotoninérgicas del sistema nervioso central, porque no atraviesa la barrera hematoencefálica. Sin embargo, el triptófano y su metabolito 5-hidroxitriptófano (5-HTP), a partir del cual se sintetiza la serotonina, sí atraviesan la barrera hematoencefálica. Estos agentes están disponibles como suplementos dietéticos y en varios alimentos, y pueden ser agentes serotoninérgicos eficaces. Un producto de la descomposición de la serotonina es el ácido 5-hidroxiindolacético (5-HIAA), que se elimina por la orina. La serotonina y el 5-HIAA son producidos a veces en cantidades excesivas por ciertos tumores o cánceres, y los niveles de estas sustancias pueden ser medidos en la orina para analizar estos tumores.
Para más informacion Serotonin
Como citar este artículo:
APA: (2022-03-08). Serotonina. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/serotonina/
ACS: . Serotonina. https://quimicafacil.net/compuesto-de-la-semana/serotonina/. Fecha de consulta 2026-02-17.
IEEE: , "Serotonina," https://quimicafacil.net/compuesto-de-la-semana/serotonina/, fecha de consulta 2026-02-17.
Vancouver: . Serotonina. [Internet]. 2022-03-08 [citado 2026-02-17]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/serotonina/.
MLA: . "Serotonina." https://quimicafacil.net/compuesto-de-la-semana/serotonina/. 2022-03-08. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net