Actualizado en marzo 24, 2022
Tiempo de lectura estimado: 5 minutos
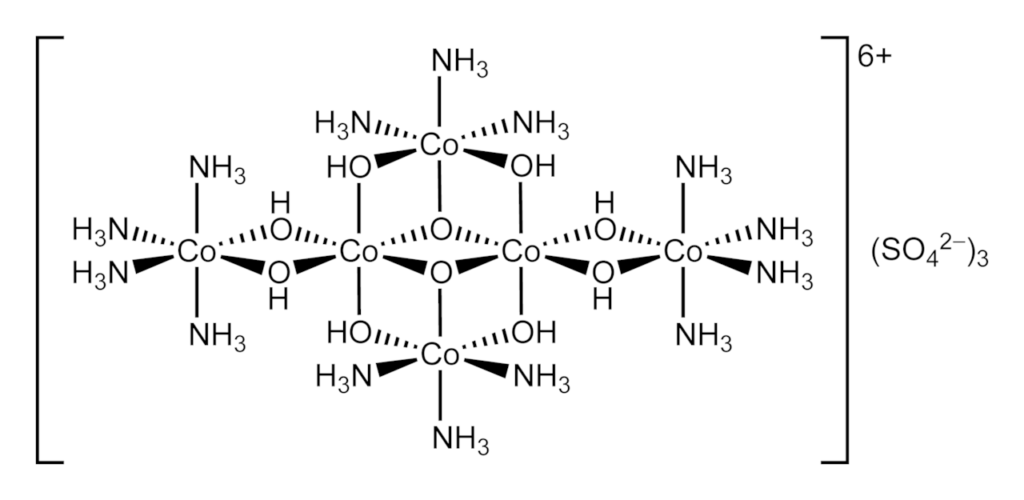
Hexol es el nombre de varias sales de un complejo de coordinación que tiene importancia histórica. Las sales fueron los primeros compuestos quirales sintéticos que no contenían carbono. La sal de sulfato tiene la fórmula {[Co(NH3)4(OH)2]3Co}(SO4)3
Complejos de Werner
La historia de la química de coordinación moderna ha sido objeto de varios libros, de los cuales quizás los más conocidos son los de George B. Kauffman. Todos ellos destacan por necesidad a Alfred Werner, «el padre de la química de coordinación», quien, en 1893, como joven profesor no remunerado de química orgánica, propuso los modelos octaédricos y planares cuadrados para los complejos metálicos de transición.
Ese mismo año, Werner fue nombrado en la Universidad de Zúrich para enseñar química orgánica y, posteriormente, 45 de sus 174 publicaciones trataron de la química orgánica de las oximas, los ácidos hidroxámicos y los colorantes, etc. De hecho, no fue hasta 1902-1903 cuando empezó a impartir el curso principal de química inorgánica.
Durante el período comprendido entre 1893 y su muerte en 1919, dirigió numerosas tesis (unas 200 en total, 56 de ellas entre 1894 y 1902) y mantuvo un vibrante laboratorio que, evidentemente, debió beneficiarse de colaboradores de países tan diversos como Japón, Italia, Reino Unido, Suecia, Estados Unidos y la URSS.
En 1913, recibió el premio Nobel el primero en Química Inorgánica. Fue elegido «en reconocimiento a sus trabajos sobre la unión de los átomos en las moléculas, con los que ha arrojado nueva luz sobre viejos problemas y ha abierto nuevos campos de investigación, en particular en la química inorgánica».
Hexol
Una consecuencia del modelo octaédrico de Werner fue que los isómeros ópticos deberían ser posibles para ciertos tipos de complejos. No está claro cuándo se dio cuenta Werner, ya que no fue hasta 1897, es decir, 4 años después de la propuesta original, que mencionó en una carta a Arturo Miolati que estaba buscando complejos ópticos. (Fue con Miolati que había publicado su primer trabajo experimental sobre complejos de coordinación, que trataba de la conductancia molecular)
En junio de 1911, cuando Victor King resolvió con éxito el cis-[CoCl(en)2NH3]2+, Werner se saltó una conferencia nocturna, un evento muy inusual. Al parecer, le preocupaba que la muestra se produjera de la noche a la mañana y quería preparar los derivados y recoger la mayor cantidad de información lo antes posible. Como sucedió, las muestras eran bastante estables.

En ocho años, Werner y sus estudiantes habían resuelto otros 40 complejos. Sin embargo, debido a la opinión predominante de que la actividad óptica estaba íntegramente relacionada con los átomos C, Werner decidió que era necesario preparar un complejo completamente inorgánico (es decir, sin átomos C) para demostrar que «los compuestos inorgánicos libres de carbono también pueden existir como isómeros de imagen especular».
La comunicación de Werner que trataba de la resolución y la actividad óptica del hexol como sales de bromuro (tris-{tetraammina-u-dihidroxo-cobalto(III)}cobalto(III) bromuro dihidrato) se publicó en 1914. Le había llevado 11 años desde la propuesta original del modelo octaédrico acumular suficientes pruebas experimentales para finalmente silenciar a sus oponentes.
El material de partida de su esquema era o bien sulfato de hexol, que convirtió en cloruro al reaccionar con cloruro de bario, o bien cloruro de hexol obtenido de [CoCl(NH3)4(H2O)]Cl2. Luego trató esta sal de cloruro de Hexol con el agente disolvente, d(+)-bromocamforsulfonato de plata, en ácido acético diluido.
Se encontró que la especie menos soluble (primer precipitado) era la sal de d-Hexol que luego se convirtió en el bromuro. A partir del filtrado, el isómero L podía aislarse y convertirse también en bromuro.
Más recientemente, se ha logrado una mayor pureza óptica de los isómeros utilizando bis(u-d-tartrato)-diantimonato(III) de sodio como agente de resolución.
Síntesis
Las sales de hexol fueron descritas por primera vez por Jørgensen. La sal de hexol se prepara calentando [Co(NH3)4(H2O)2]3+ con una base diluida como el amoníaco seguido de la precipitación de la sal de sulfato:
Dependiendo de las condiciones se obtiene el 9-hidrato, el 6-hidrato y el 4-hidrato. Estas sales existen en forma de cristales tabulares de color marrón oscuro o negro. Las sales tienen una baja solubilidad en el agua. El catión puede precipitarse cuantitativamente a partir de sus sales de cromato y hexacloroplatino de color gris amarillento. Cuando se trata con ácido clorhídrico concentrado, el hexol se convierte en sulfato de cis-diaquotetramminecobalto(III). En el ácido sulfúrico diluido en ebullición, el hexol se degrada con la evolución del oxígeno y el nitrógeno.
El «segundo hexol»
Werner también describió un segundo hexol aciral (un subproducto menor de la producción de la sal de Fremy) que identificó incorrectamente como un tetrámero lineal. El segundo hexol es hexanuclear (contiene seis centros de cobalto en cada ión), no tetranuclear.
Para más información The Rediscovery of Alfred Werner?s Second Hexol.
Como citar este artículo:
APA: (2021-03-23). Hexol. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/hexol/
ACS: . Hexol. https://quimicafacil.net/compuesto-de-la-semana/hexol/. Fecha de consulta 2024-10-25.
IEEE: , "Hexol," https://quimicafacil.net/compuesto-de-la-semana/hexol/, fecha de consulta 2024-10-25.
Vancouver: . Hexol. [Internet]. 2021-03-23 [citado 2024-10-25]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/hexol/.
MLA: . "Hexol." https://quimicafacil.net/compuesto-de-la-semana/hexol/. 2021-03-23. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net