Tiempo de lectura estimado: 4 minutos
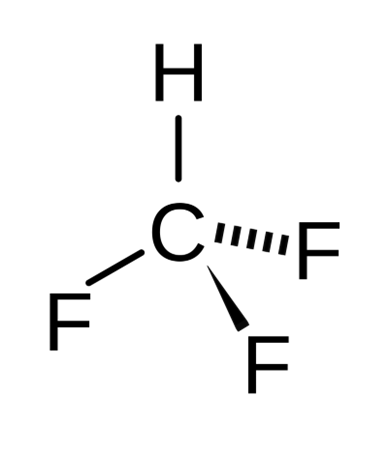
El trifluorometano o fluoroformo es un compuesto químico de fórmula CHF3. Es una de las haloformas, una clase de compuestos con la fórmula CHX3 (X = halógeno) con simetría C3v. El fluoroformo se utiliza en diversas aplicaciones de síntesis orgánica. No agota la capa de ozono, pero es un gas de efecto invernadero.
Historia del fluoroformo
El fluoroformo fue obtenido por primera vez por Maurice Meslans usando una violenta reacción de iodoformo con fluoruro de plata seco en 1894. Posteriormente la reacción fue mejorada por Otto Ruff mediante la sustitución del fluoruro de plata por una mezcla de fluoruro de mercurio y fluoruro de calcio.
La reacción de intercambio funciona con iodoformo y bromoformo, y el intercambio de los dos primeros átomos de halógeno por flúor es vigoroso. Al cambiar a un proceso de dos pasos, primero formando un bromodifluorometano en la reacción de trifluoruro de antimonio con bromoformo y terminando la reacción con fluoruro de mercurio, Henne encontró el primer método de síntesis eficiente.
Hoy en día, el fluoroformo se produce en grandes cantidades como un subproducto económico de la fabricación del Teflón de DuPont. También se encuentra en la naturaleza, especialmente sobre sedimentos de marismas salinas, donde algunas bacterias son capaces de degradar CF3COOH en CHF3.
Aplicaciones del fluoroformo
El fluoroformo es débilmente ácido con un pKa = 25-28 y bastante inerte. La desprotonación intentada resulta en la defluorinación para generar F− y difluorocarbeno (CF2). Se han desarrollado algunos compuestos de organocobre y organocadmio como reactivos de trifluorometilación.
Uso industrial
Cuando se utiliza como supresor de incendios, el fluoroformo lleva el nombre comercial de DuPont, FE-13. CHF3 se recomienda para esta aplicación debido a su baja toxicidad, su baja reactividad y su alta densidad. HFC-23 se ha utilizado en el pasado como reemplazo de Halon 1301 en sistemas de supresión de incendios como agente de supresión de incendios gaseoso de inundación total.
Química orgánica
El anión trifluorometilo es potencialmente valioso para la incorporación del importante grupo CF3 en muchas moléculas orgánicas. Sin embargo, la generación de tal especie a partir de iodotrifluorometano resultó ser difícil debido a su baja estabilidad (CF3−: CF2 + F−).
Durante las investigaciones, el fluoroformo demostró ser superior a los fluoroalometanos como precursor del anión CF3, a pesar de su muy baja acidez (pKa estimado = 25-28) . Se han desarrollado dos métodos principales para extraer el protón de CHF3, el uso de bases electrogeneradas y el uso de bases más fácilmente disponibles, generalmente con modificaciones especiales.
También se ha demostrado que una forma eficiente de generar el anión CF3 es mediante la reducción electroquímica de 2-pirrolidona para formar el correspondiente anión de pirrolidona, estabilizado por DMF. Este anión es capaz, a su vez, de desprotonar el fluoroformo.
El trifluorometano es un precursor del reactivo de Ruppert-Prakash CF3Si(CH3)3, que es una fuente del anión nucleófilo CF–3.
El fluoroformo como gas de efecto invernadero
El fluoroformo es un potente gas de efecto invernadero. Una tonelada de HFC-23 en la atmósfera tiene el mismo efecto que 11,700 toneladas de dióxido de carbono. Esta equivalencia, también llamada potencial de calentamiento global de 100 años, es ligeramente mayor en 14,800 para HFC-23. La vida atmosférica es de 270 años.
El HFC-23 fue el fluoroformo más abundante en la atmósfera global hasta alrededor de 2001, momento en que la concentración media global de HFC-134a (1,1,1,2-tetrafluoroetano), el producto químico ahora utilizado ampliamente en los acondicionadores de aire de los automóviles, superó a la de HFC-23. Las emisiones globales de HFC-23 en el pasado han sido dominadas por la producción y liberación inadvertida durante la fabricación del refrigerante HCFC-22 (clorodifluorometano).
Se informaron disminuciones sustanciales en las emisiones de HFC-23 por parte de los países desarrollados desde la década de 1990 hasta la de 2000: de 6-8 Gg / año en la década de 1990 a 2.8 Gg / año en 2007.
El Mecanismo de Desarrollo Limpio de la CMNUCC proporcionó financiamiento y facilitó la destrucción del HFC-23.
Los países en desarrollo se han convertido en los mayores productores de HCFC-23 en los últimos años, según datos compilados por la Secretaría del Ozono de la Organización Meteorológica Mundial. Las emisiones de todos los HFC están incluidas en el Protocolo de Kyoto de la CMNUCC. Para mitigar su impacto, el fluoroformo puede ser destruido con tecnologías de arco de plasma eléctrico o por incineración a alta temperatura.
Para más información trifluoromethane
Como citar este artículo:
APA: (2023-12-12). Fluoroformo. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/fluoroformo/
ACS: . Fluoroformo. https://quimicafacil.net/compuesto-de-la-semana/fluoroformo/. Fecha de consulta 2024-07-27.
IEEE: , "Fluoroformo," https://quimicafacil.net/compuesto-de-la-semana/fluoroformo/, fecha de consulta 2024-07-27.
Vancouver: . Fluoroformo. [Internet]. 2023-12-12 [citado 2024-07-27]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/fluoroformo/.
MLA: . "Fluoroformo." https://quimicafacil.net/compuesto-de-la-semana/fluoroformo/. 2023-12-12. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net