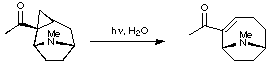Tiempo de lectura estimado: 11 minutos
La anatoxina A, también conocida como Factor de Muerte Muy Rápida (Very Fast Dead factor – VFDF), es un alcaloide amínico secundario, bicíclico y cianotoxina con neurotoxicidad aguda. Fue descubierta por primera vez a principios de los años sesenta en Canadá, y fue aislada en 1972.
La toxina es producida por múltiples géneros de cianobacterias y se ha encontrado en América del Norte, América del Sur, América Central, Europa, África, Asia y Oceanía. Los síntomas de la toxicidad de la anatoxina A incluyen la pérdida de coordinación, fasciculaciones musculares, convulsiones y muerte por parálisis respiratoria.
Su modo de acción es a través del receptor nicotínico de acetilcolina (nAchR), donde imita la unión del ligando natural del receptor, la acetilcolina. Como tal, la anatoxina A se ha utilizado con fines medicinales para investigar enfermedades caracterizadas por bajos niveles de acetilcolina. Debido a su alta toxicidad y a su posible presencia en el agua potable, la anatoxina A representa una amenaza para los animales, incluidos los seres humanos.
Si bien existen métodos de detección y tratamiento del agua, los científicos han pedido que se realicen más investigaciones para mejorar la fiabilidad y la eficacia. La anatoxina A no debe confundirse con la guanitoxina (anteriormente anatoxina A(S)), otra potente cianotoxina que tiene un mecanismo de acción similar al de la anatoxina A y es producida por muchos de los mismos géneros de cianobacterias, pero no está estructuralmente relacionada
Características de la anatoxina A
La anatoxina es una potente toxina alcaloide derivada de una especie de cianobacteria llamada Anabaena flos-aquae. El primer informe publicado sobre los efectos potencialmente letales de los microorganismos conocidos como algas verde-azuladas apareció en Nature en 1878. George Francis describió una floración de algas que se había formado en el estuario del río Murray, en Australia, como «una espesa escoria como la pintura verde al óleo, de unos dos a seis centímetros de espesor».
El agua en este punto del río se volvió tóxica para la vida silvestre, y los animales que la bebían se enfermaban rápidamente y morían de forma terrible. El efecto de las toxinas microalgas, tanto en el medio ambiente marino como en el de agua dulce, ha aumentado su gravedad en los últimos años, y los episodios de envenenamiento se están volviendo más comunes y extendidos. Por ejemplo, en el medio oeste de los Estados Unidos, el consumo de agua contaminada ha provocado la muerte de miles de patos y gansos.
La preocupación por la vida silvestre y también las cuestiones relacionadas con la salud pública llevaron a que se investigaran mucho las causas de estas muertes masivas de animales, y en los decenios de 1950 y 1960 Paul Gorham y sus colaboradores del Consejo Nacional de Investigaciones de Ottawa establecieron cultivos para Anabaena flos-aquae, que les permitieron aislar los compuestos venenosos que produce.
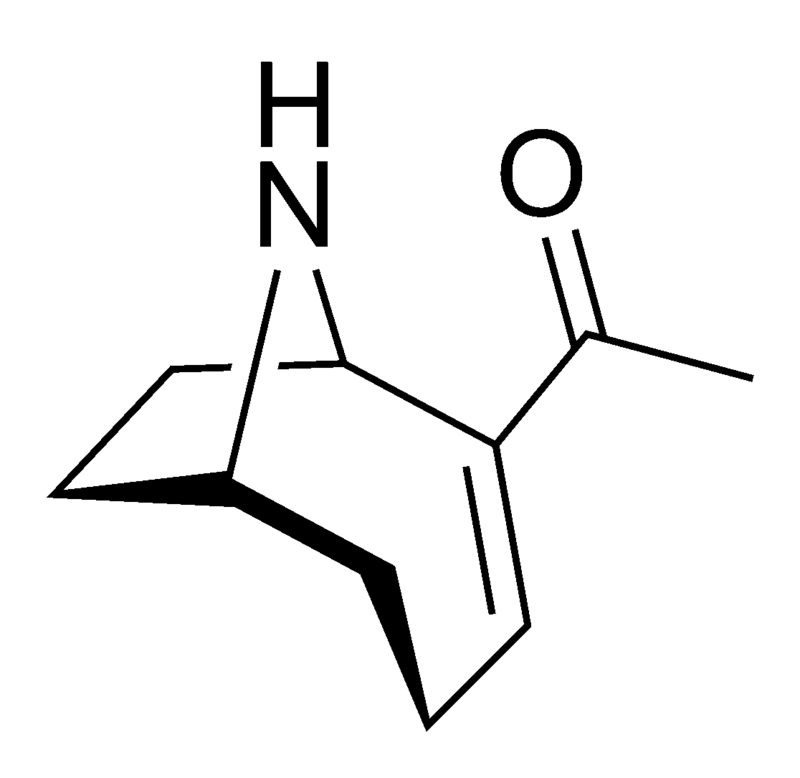
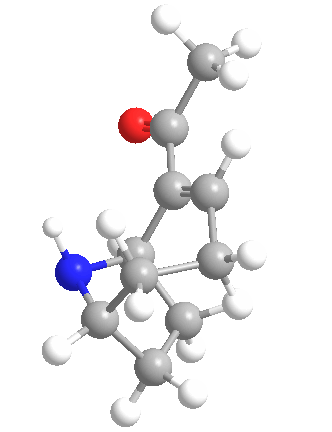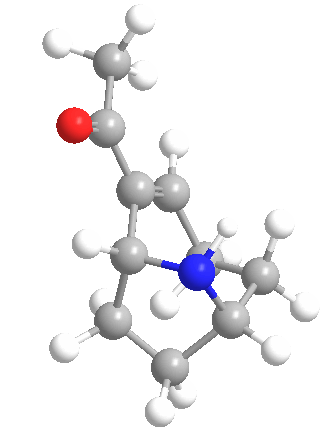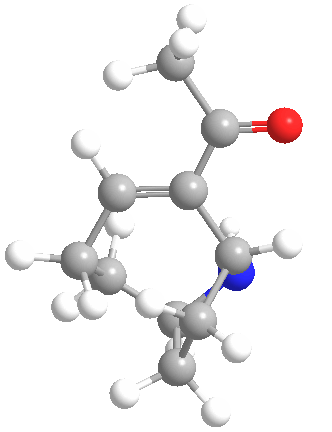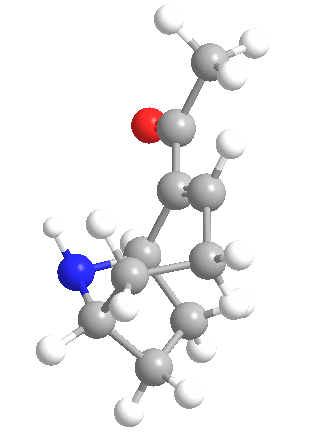
La anatoxina A es quizás una de las más tóxicas de las toxinas de las cianobacterias de este grupo, ya que los efectos de su ingestión pueden ser letales en 4 minutos, dependiendo de la cantidad consumida. Esto llevó a que el compuesto fuera apodado «Factor de Muerte Muy Rápida». Se muestra la estructura química (arriba) y es un interesante alcaloide bicíclico, y se esperaba que el conocimiento de esta estructura permitiera a los científicos descubrir el modo de acción de la toxina.
La anatoxina es una neurotoxina grave y, como tal, afecta al funcionamiento del sistema nervioso, causando a menudo la muerte por parálisis de los músculos respiratorios. Se sabe que actúa como un imitador del neurotransmisor, la acetilcolina, y se une irreversiblemente al receptor nicotínico de la acetilcolina (NAChR). La acción neuromuscular normal implica la liberación de acetilcolina, que se une a su receptor, lo que conduce a la apertura de un canal de sodio relacionado. El movimiento resultante de los iones de sodio produce el potencial de acción que hace que los músculos se contraigan.
En este punto, una enzima llamada acetilcolinesterasa rompe el neurotransmisor, permitiendo que el canal de sodio regrese eventualmente a su estado de reposo, y por lo tanto el músculo puede relajarse. La anatoxina A también se une al NAChR para producir un potencial de acción, pero no puede ser cortado por la enzima. El canal de sodio está esencialmente bloqueado abierto, y los músculos se sobreestimulan y se fatigan y luego se paralizan. Cuando los músculos respiratorios se ven afectados, se producen convulsiones debido a la falta de suministro de oxígeno al cerebro. La asfixia es el resultado final unos minutos después de la ingestión de la toxina.
La anatoxina y sus aplicaciones científicas y médicas
Sin embargo, a pesar de su naturaleza venenosa, la anatoxina A y muchos análogos artificiales conexos se han utilizado ampliamente en la medicina y en aplicaciones farmacológicas. Dado que se une al receptor nicotínico de la acetilcolina de manera irreversible, es un medio excelente para estudiar este receptor, y también los mecanismos de acción neuromuscular. Se están utilizando análogos modificados para dilucidar mejor los subtipos de receptores, y esta investigación puede conducir al desarrollo de nuevos medicamentos que no tengan ninguna de las toxicidades asociadas a la anatoxina en sí, pero que actúen meramente como candidatos a la sustitución de la acetilcolina.
Por ejemplo, el trastorno neurodegenerativo, la enfermedad de Alzheimer, se asocia con la incapacidad de las neuronas para producir acetilcolina. El uso del propio neurotransmisor como terapia no funcionaría ya que no es lo suficientemente longevo. Un agonista más estable (¡y no tóxico!) similar a la anatoxina podría funcionar muy bien.
En 1977, Carmichael, Gorham y Biggs experimentaron con la anatoxina A. Introdujeron cultivos tóxicos de A. flos-aquae en los estómagos de dos terneros machos jóvenes y observaron que las fasciculaciones musculares y la pérdida de coordinación se producían en cuestión de minutos, mientras que la muerte por insuficiencia respiratoria se producía en cualquier momento entre varios minutos y unas pocas horas.
También establecieron que los extensos períodos de respiración artificial no permitían que se produjera la desintoxicación y se reanudara el funcionamiento neuromuscular natural. A partir de estos experimentos, calcularon que la dosis letal mínima oral (DLM) (de las algas, no de la molécula de anatoxina), para los terneros es de aproximadamente 420 mg/kg de peso corporal.
Ese mismo año, Devlin y sus colegas descubrieron la estructura amínica secundaria bicíclica de la anatoxina A. También realizaron experimentos similares a los de Carmichael et al. en ratones. Encontraron que la anatoxina A mata a los ratones 2-5 minutos después de la inyección intraperitoneal precedida de espasmos musculares, parálisis y paro respiratorio, de ahí el nombre de Factor de Muerte Muy Rápida. Determinaron que el LD50 de los ratones era de 250 µg/kg de peso corporal.
Los experimentos electrofisiológicos realizados por Spivak et al. (1980) en ranas mostraron que la anatoxina A es un potente agonista del tipo muscular α12βγδ nAChR. La anatoxina A indujo el bloqueo neuromuscular despolarizador, la contracción del músculo recto abdominal de la rana, la despolarización del músculo sartorio de la rana, la desensibilización y la alteración del potencial de acción. Más tarde, Thomas y otros (1993), a través de su trabajo con el pollo α4β2 subunidades nAChR expresadas en células M 10 de ratón y el pollo α7 nAChR expresadas en ovocitos de Xenopus laevis, demostraron que la anatoxina A es también un potente agonista del nAChR neuronal.
Biosíntesis
La anatoxina A se sintetiza in vivo en la especie Anabaena flos aquae, así como en varios otros géneros de cianobacterias. La anatoxina A y las estructuras químicas conexas se producen utilizando acetato y glutamato. Una mayor reducción enzimática de estos precursores da lugar a la formación de la anatoxina A. La homoanatoxina, una sustancia química similar, es producida por la Oscillatoria formosa y utiliza el mismo precursor. Sin embargo, la homoanatoxina se somete a una adición de metilo por S-adenosil-L_metionina en lugar de una adición de electrones, lo que da lugar a un análogo similar.
Síntesis de laboratorio
Expansión cíclica de los tropanos
La primera sustancia inicial de origen biológico para la expansión del tropano en la anatoxina A fue la cocaína, que tiene una estereoquímica similar a la de la anatoxina A. La cocaína se convierte primero en el endoisómero del ciclopropano, que luego se corta fotolíticamente para obtener una cetona insaturada alfa, beta.
Mediante el uso de azodicarboxilato de dietilo, la cetona se desmetila y se forma la anatoxina A. Una vía de síntesis similar, más reciente, consiste en producir 2-tropinona a partir de la cocaína y tratar el producto con cloroformo de etilo produciendo una cetona bicíclica. Este producto se combina con trimetilsilildiazilmetano, un ácido organoalumínico de Lewis y éter de trimetilsinil enol para producir tropinona. Este método se somete a varios pasos más, produciendo intermedios útiles, así como anatoxina A como producto final.
Ciclización de los ciclooctenos
El primer enfoque, y el más ampliamente explorado, utilizado para sintetizar la anatoxina, una ciclización del cicloocteno in vitro, tiene como fuente inicial el 1,5-ciclooctadieno. Esta sustancia inicial se hace reaccionar para formar metilamina y se combina con el ácido hipobromoso para formar la anatoxina-a.
Otro método desarrollado en el mismo laboratorio utiliza el aminoalcohol junto con el acetato mercúrico (II) y el borohidruro sódico. El producto de esta reacción se transformó en una cetona alfa, beta y se oxidó por el azodicarboxilato de etilo para formar la anatoxina-a.
Estrategia de enolización enantioselectiva
Este método de producción de anatoxina fue uno de los primeros que se utilizaron que no utiliza una sustancia inicial químicamente análoga para la formación de anatoxina. En su lugar, se utiliza una mezcla racémica de 3-tropinona con una base de amida de litio quiral y reacciones adicionales de expansión de anillo para producir un intermedio de cetona. La adición de un organocuprato a la cetona produce un derivado de triflato de enol, que luego se lisan con hidrógeno y se tratan con un agente desprotector para producir la anatoxina A. Otros laboratorios han desarrollado y utilizado estrategias similares.
Ciclización intramolecular de los iones de iminio
La ciclización del ión iminio utiliza varias vías diferentes para crear la anatoxina A, pero cada una de ellas produce y progresa con un ión iminio de pirrolidina. Las principales diferencias en cada vía se relacionan con los precursores utilizados para producir el ión imonio y el rendimiento total de la anatoxina A al final del proceso. Estas vías separadas incluyen la producción de sales de alquil iminio, sales de iminio acílico y sales de iminio tosilo.
Metátesis de enino
La metátesis de la anatoxina A implica el uso de un mecanismo de cierre de anillo y es uno de los avances más recientes en la síntesis de la anatoxina A. En todos los métodos que involucran esta vía, el ácido piroglutámico se utiliza como material de partida en conjunto con un catalizador de Grubb. De manera similar a la ciclización del iminio, el primer intento de síntesis de la anatoxina A usando esta vía utilizó una 2,5-cis-pirrolidina como intermediario.
Casos de toxicidad por anatoxina-A
Desde su descubrimiento se han notificado muchos casos de muertes de animales salvajes y ganado debido a la anatoxina A. Se han observado muertes de perros domésticos debidas a la cianotoxina, según se ha determinado mediante análisis del contenido del estómago, en la parte baja de la Isla del Norte en Nueva Zelanda en 2005, en el este de Francia en 2003, en California de los Estados Unidos en 2002 y 2006, en Escocia en 1992, y en Irlanda en 1997 y 2005.
En cada caso los perros comenzaron a mostrar convulsiones musculares en cuestión de minutos, y murieron en cuestión de horas. Se han reportado numerosas muertes de ganado debido al consumo de agua contaminada con cianobacterias que producen anatoxina A en los Estados Unidos, Canadá y Finlandia entre 1980 y el presente.
Un caso particularmente interesante de intoxicación por anatoxina A es el de los flamencos menores del lago Bogoria en Kenya. La cianotoxina, que se identificó en los estómagos y los gránulos fecales de las aves, mató a unos 30.000 flamencos en el segundo semestre de 1999 y sigue causando anualmente muertes masivas, devastando la población de flamencos. La toxina se introduce en las aves a través del agua contaminada con comunidades de esteras de cianobacterias que surgen de las aguas termales del lecho del lago.
Para más información Chapter 3. CYANOBACTERIAL TOXINS
Como citar este artículo:
APA: (2021-07-06). Anatoxina-A. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/anatoxina-a/
ACS: . Anatoxina-A. https://quimicafacil.net/compuesto-de-la-semana/anatoxina-a/. Fecha de consulta 2026-03-03.
IEEE: , "Anatoxina-A," https://quimicafacil.net/compuesto-de-la-semana/anatoxina-a/, fecha de consulta 2026-03-03.
Vancouver: . Anatoxina-A. [Internet]. 2021-07-06 [citado 2026-03-03]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/anatoxina-a/.
MLA: . "Anatoxina-A." https://quimicafacil.net/compuesto-de-la-semana/anatoxina-a/. 2021-07-06. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net