Actualizado en septiembre 15, 2021
Tiempo de lectura estimado: 9 minutos
El Azul de Ftalocianina BN, también llamado por muchos nombres como Azul monástico, azul ftalo, azul tálico o CuPc (EINECS 205-685-1), es un pigmento azul sintético brillante y cristalino del grupo de los colorantes de ftalocianina.
Su azul brillante se usa frecuentemente en pinturas y tintes. Es muy apreciado por sus propiedades superiores, como la solidez a la luz, la fuerza de teñido, el poder de cobertura y la resistencia a los efectos de los álcalis y los ácidos. Tiene la apariencia de un polvo azul, insoluble en la mayoría de los solventes, incluyendo el agua.
Historia
La historia de azul monástico no trata de un personaje de la Flauta Mágica, sino que es un clásico de la serendipia química, la colaboración entre la industria y la universidad, la influencia teórica, y de mucho más. Afortunadamente, gran parte de esa historia está realmente registrada en el cine (en sí mismo un archivo único que data de 1933 y es una de las primeras películas en color que existen).
Patrick Linstead, un joven químico de entonces (que finalmente ascendió a rector del Imperial College) cuenta la historia aquí mismo. Vale la pena verla, aunque sólo sea por su inocente comentario social sobre el sistema de clases inglés (y una actitud sobre la seguridad en los laboratorios que no debería ser copiada hoy en día).
El CuPc se preparó por primera vez en 1927 mediante la reacción de cianuro de cobre(I) y o-dibromobenceno, con la aparente intención de preparar ftalonitrilo. Un par de años más tarde, los trabajadores de Escocia obtuvieron CuPc, FePc y NiPc a partir de reacciones de anhídrido ftálico y amoníaco.

Específicamente en la planta de ftalimida ICI, se rastreó un contaminante azul a un subproducto formado cuando la ftalimida reaccionó con trazas de hierro del reactor de metal. El químico tomó muestras de este azul y usando ácido sulfúrico como disolvente, logró producir un pigmento viable. Estas pistas condujeron al pigmento azul que se vende bajo el nombre comercial de Monastral. La producción industrial comenzó en 1935 en ICI, I.G. Farbenindustrie y DuPont.
Se experimentó la dificultad de formar dispersiones estables con las primeras formas alfa, especialmente en mezclas con titanio rutilo, donde el pigmento azul tendía a flocularse. La forma beta era más estable, al igual que la forma alfa estabilizada mejorada. Hoy en día, hay incluso más formas isoméricas disponibles.
Química del azul de Ftalocianina
En 1933, Hückel todavía pensaba en su teoría electrónica orbital molecular del benceno, pero durante ~15 años, no hubo mucha necesidad de la regla que ahora conocemos como 4n+2, ¡porque n era invariablemente igual a 1 para la mayoría de las moléculas aromáticas conocidas!

Fue sólo el descubrimiento de los llamados aromáticos no bencenoides en la década de 1940 (por ejemplo, la estructura de tropolones de Dewar) lo que impulsó a los químicos a identificar las moléculas aromáticas con otros valores de n. Y el azul monacal es un ejemplo excelente de n=4 (aunque sería interesante saber cuándo se asoció así con la regla de Hückel).
Si contamos los enlaces rojos de arriba, hay ocho, junto con un único par de electrones ubicados en el átomo de nitrógeno resaltado (azul). Esto hace que haya 18 π-electrones en el anillo, o 4×4+2 (hay caminos distintos al que se muestra, pero dan la misma cuenta). Parte de la razón de la notable estabilidad térmica de esta molécula debe ser su aromaticidad.
¿Y qué hay del color? El espectro visible se muestra a continuación, con λmax ~ 610 y 710nm.

Bueno, un cálculo de TD-DFT ωB97Xd/6-31G(d) revela lo siguiente. Esto reproduce la banda a 610nm muy bien, pero deja la identidad de la banda a 710nm misteriosa. ¿Cómo se origina eso? Se podría especular que esto podría surgir de la presencia de otra especie. Así, la propia ftalocianina de cobre es neutra, pero podría ser fácilmente oxidada a un catión, y esto podría entonces formar un complejo 1:1 π con una segunda molécula del radical neutro (DOI:10.1021/ja00238a021)

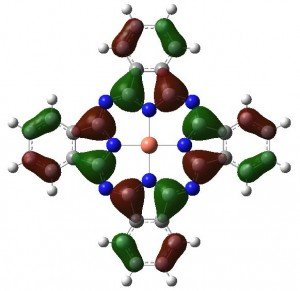
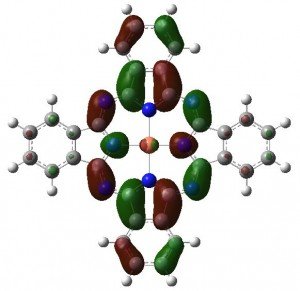
La excitación electrónica a ~610nm surge de los siguientes MOs:
El electrón no apareado de la ftalocianina de cobre ocupa la siguiente órbita bastante interesante, que parece no estar involucrada en su color azul.

Así que, al igual que con la malvaina, queda un misterio. El color del azul monacal no es monocromático, ya que parece estar causado por dos bandas en la región de 600-700. Sin embargo, los cálculos revelan que sólo tiene una banda a 610 nm. ¿Cuál es la otra?
Aplicaciones
Las ftalocianinas metálicas han sido examinadas durante mucho tiempo como catalizadores de reacciones redox. Las áreas de interés son la reacción de reducción de oxígeno y el endulzamiento de las corrientes de gas mediante la eliminación del sulfuro de hidrógeno.
Colorante
Debido a su estabilidad, el azul de ftalo o azul monastico también se utiliza en tintas, revestimientos y muchos plásticos. El pigmento es insoluble y no tiene tendencia a migrar en el material. Es un pigmento estándar usado en tintas de impresión y en la industria del embalaje. La producción industrial fue del orden de 10.000 toneladas por año en los años 80 y 90 sólo en Japón. El pigmento es el pigmento de mayor volumen producido.

Todos los principales fabricantes de pigmentos para artistas producen variantes de ftalocianina de cobre, designadas con el índice de color PB15 (azul) y los índices de color PG7 y PG36 (verde).
Un componente común en la paleta del artista, el azul de ftalocyanina es un azul frío con un sesgo hacia el verde. Tiene un intenso poder de tinte y fácilmente supera a la mezcla cuando se combina con otros colores. Es un color de tinte transparente y puede ser aplicado usando técnicas de vidriado.
Este color también está presente en la pasta dental Dentalux Total Care Plus de Lidl, que figura como el ingrediente final.
Uso en investigación
Aunque nunca se ha comercializado, el CuPc se ha investigado a menudo en el contexto de la electrónica molecular. Es muy adecuado para las células solares orgánicas debido a su alta estabilidad química y su crecimiento uniforme. El CuPc suele desempeñar el papel de donante de electrones en las células solares basadas en donantes/aceptores. Una de las arquitecturas más comunes de donante/receptor es la de CuPc/C60 (buckminsterfullereno) que rápidamente se convirtió en un sistema modelo para el estudio de pequeñas moléculas orgánicas. La eficiencia de conversión de fotones a electrones en dicho sistema alcanza aproximadamente el 5%.
El CuPc ha sido investigado como un componente de los transistores orgánicos de efecto de campo. Se ha sugerido la ftalocianina de cobre (CuPc) para el almacenamiento de datos en la computación cuántica, debido al tiempo que sus electrones pueden permanecer en superposición.
El compuesto también ha sido investigado en el contexto de la computación cuántica. El CuPc puede ser fácilmente procesado en una película delgada para su uso en la fabricación de dispositivos, lo que lo convierte en un atractivo candidato a qubit.
Derivados del azul de ftalocianina
Aproximadamente el 25% de todos los pigmentos orgánicos artificiales son derivados de la ftalocianina. Los colorantes de ftalocianina de cobre (CuPc) se producen mediante la introducción de grupos solubilizantes, como una o más funciones de ácido sulfónico. Estos colorantes encuentran un amplio uso en diversas áreas del teñido de textiles (Colorantes directos para algodón), para el teñido de hilados y en la industria del papel. El azul directo 86 es la sal sódica del ácido CuPc-sulfónico, mientras que el azul directo 199 es la sal de amonio cuaternario del ácido CuPc-sulfónico.
Las sales de amonio cuaternario de estos ácidos sulfónicos se utilizan como colorantes disolventes debido a su solubilidad en disolventes orgánicos, como el Solvent Blue 38 y el Solvent Blue 48. El colorante derivado de la ftalocianina de cobalto y una amina es el tinte ftalógeno IBN. El 1,3-Diiminoisoindoleno, el intermediario formado durante la fabricación de ftalocianina, utilizado en combinación con una sal de cobre da el colorante GK 161. El azul de ftalocianina BN también se utiliza como material de partida para la fabricación de ftalocianina Verde G.
Toxicidad
El azul monástico o CuPc no es biodegradable, pero no es tóxico para los peces o las plantas. No se han asociado peligros específicos con este compuesto. Se estima que la LD50 oral en mamíferos es superior a 5 g por kg, sin que se encuentren efectos nocivos a ese nivel de ingestión, para la ingestión crónica la dosis estimada de baja preocupación fue 0. 2 mg/kg por día en ratas.
No se han encontrado pruebas que indiquen efectos cancerígenos. Se ha descubierto que la ftalocianina sulfonada causa defectos neuroanatómicos en los embriones de pollo en desarrollo cuando se inyecta directamente en los huevos en incubación.
Para más información Monastral: the colour of blue
Como citar este artículo:
APA: (2020-10-08). Azul de Ftalocianina. Recuperado de https://quimicafacil.net/ciencia-y-arte/azul-de-ftalocianina/
ACS: . Azul de Ftalocianina. https://quimicafacil.net/ciencia-y-arte/azul-de-ftalocianina/. Fecha de consulta 2024-10-28.
IEEE: , "Azul de Ftalocianina," https://quimicafacil.net/ciencia-y-arte/azul-de-ftalocianina/, fecha de consulta 2024-10-28.
Vancouver: . Azul de Ftalocianina. [Internet]. 2020-10-08 [citado 2024-10-28]. Disponible en: https://quimicafacil.net/ciencia-y-arte/azul-de-ftalocianina/.
MLA: . "Azul de Ftalocianina." https://quimicafacil.net/ciencia-y-arte/azul-de-ftalocianina/. 2020-10-08. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net