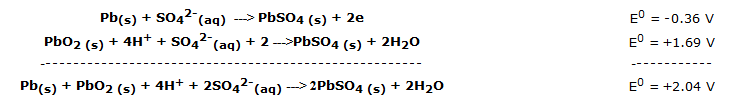Tiempo de lectura estimado: 7 minutos
La batería de plomo-ácido fue inventada en 1859 por el físico francés Gaston Planté y es el primer tipo de batería recargable. A pesar de tener una relación energía-peso muy baja y una baja relación energía-volumen, su capacidad para suministrar altas corrientes de choque hace que las celdas tengan una relación potencia-peso relativamente grande. Estas características, junto con su bajo coste, las hacen atractivas para su uso en vehículos de motor para suministrar la alta corriente que requieren los motores de arranque.
Como son baratas en comparación con otras tecnologías más recientes, las baterías de plomo-ácido se utilizan ampliamente incluso cuando la corriente de arranque no es importante y otros diseños podrían proporcionar mayores densidades de energía.
Los diseños de plomo-ácido de gran formato se utilizan ampliamente para el almacenamiento en fuentes de alimentación de reserva en torres de telefonía móvil, en entornos de alta disponibilidad como hospitales y en sistemas de alimentación independientes. Para estas funciones, pueden utilizarse versiones modificadas de la célula estándar para mejorar los tiempos de almacenamiento y reducir los requisitos de mantenimiento. Las pilas de gel y las baterías de vidrio absorbido son comunes en estas funciones, conocidas colectivamente como baterías VRLA (plomo-ácido regulado por válvula).
En el estado de carga, la energía química de la batería se almacena en la diferencia de potencial entre el plomo puro en el lado negativo y el PbO2 en el lado positivo, más el ácido sulfúrico acuoso. La energía eléctrica producida por una batería de plomo-ácido en descarga puede atribuirse a la energía liberada cuando los fuertes enlaces químicos de las moléculas de agua (H2O) se forman a partir de los iones H+ del ácido y los iones O2- del PbO2. Por el contrario, durante la carga, la batería actúa como un dispositivo de separación de agua.
Química de una batería de plomo-ácido
Los acumuladores de plomo son baterías reversibles; pueden, de hecho, acumular corriente (proceso de carga) o generar corriente (proceso de descarga), porque la reacción de oxidación-reducción que tiene lugar puede proceder en ambas direcciones.
Los acumuladores constan de un ánodo (-) formado por placas de plomo y un cátodo (+) formado por placas de plomo recubiertas de dióxido de plomo (PbO2); los electrodos se sumergen en un electrolito que consiste en una solución de aproximadamente 20 a 30 % de ácido sulfúrico.
El acumulador puede esquematizarse como sigue:
En el proceso de descarga, el acumulador actúa como una célula galvánica y suministra energía eléctrica mediante la transformación de energía química: en el ánodo (-) se produce una reacción de oxidación reversible, mientras que en el cátodo (+) hay una reacción de reducción reversible.
La f.e.m. teórica de un elemento acumulador de plomo-ácido puede calcularse fácilmente observando los potenciales de reducción estándar de las dos semirreacciones:
Este valor está referido a una situación estándar (25°C y concentración 1 M); en la práctica, un elemento de plomo en el que la concentración de H2SO4 es de 4 / 5M ( 20 / 30 % ) , la f.e.m. es de unos 2,2 v y tiende a disminuir, durante el uso, a unos 2 v.
En el proceso de carga las reacciones que se producen en los dos polos son iguales pero opuestas a las descritas, ya que son provocadas por la energía eléctrica suministrada por un generador; con ella el PbSO4 se transforma en Pb y PbO2. La tensión por suministrar debe ser de unos 2,2 v, y no debe superarse; en efecto, cuando la tensión aplicada alcanza los 2,4 v se produce la electrólisis del agua con desarrollo de H2 y O2, lo que conlleva un consumo inútil de energía eléctrica y el deterioro de las placas del acumulador, debido a la acción de los gases.
Durante el proceso de descarga es aconsejable no disminuir nunca la f.e.m. por debajo de 1,8 v por elemento. Esto llevaría al proceso de sulfatación del elemento. El PbSO4 que se forma normalmente es una sal poco soluble y se adhiere a las placas en forma de gránulos muy pequeños.
Si la f.e.m. cae por debajo de 1,8 v, se forman gránulos muy grandes que ya no pueden transformarse en el proceso de carga.
En la práctica, el fin de la vida útil de una batería de plomo-ácido se debe al proceso de sulfatación.
La reacción global de la batería de plomo-ácido es, en definitiva, la siguiente:
Materiales
- Célula electrolítica
- Fuente de alimentación DC 6/12 voltios
- Voltímetro
- Amperímetro
- Bombilla 1,5 V, 0,5 A
- Cables.
Reactivos
- 2 láminas de plomo
- Ácido sulfúrico sol. aprox. 10 %
Procedimiento
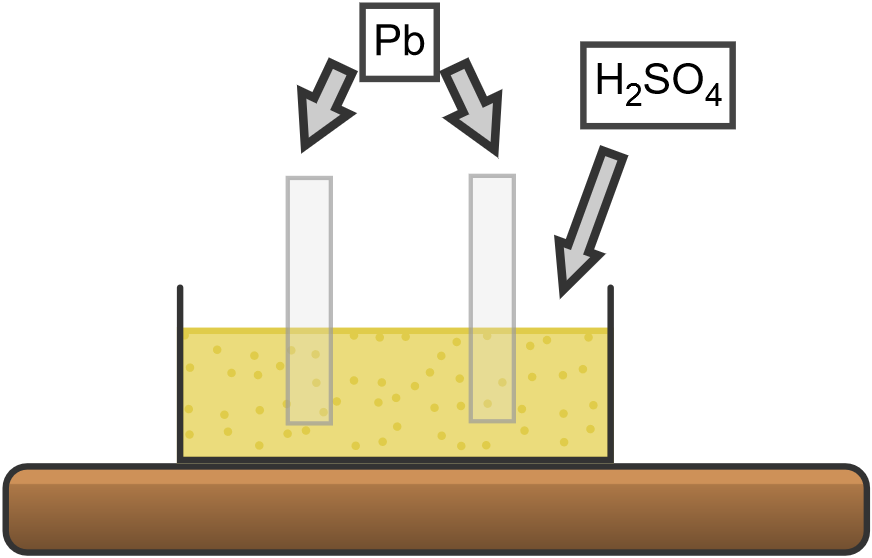
El modelo didáctico de la batería de plomo consiste en una célula electrolítica de vidrio, dos láminas de plomo y un soporte aislado.
La solución de ácido sulfúrico se coloca en la celda hasta unos 4 cm del borde.
Las láminas de plomo, montadas en el soporte aislado, se sumergen y, mediante dos cables, se conectan a un generador de corriente continua de 6V. En el ánodo se puede observar un ennegrecimiento debido a la formación de PbO2 causada por la electrólisis.
Tras unos minutos de carga, desconecte los cables y mida la f.e.m. expresada por el acumulador conectando el voltímetro a las láminas, respetando la polaridad.
Este f.e.m. expresado debe ser de unos 2 V. El tipo de corriente es, por supuesto, continua.
Después de esta fase, el acumulador se conecta al amperímetro y a un elemento para demostrar el paso de corriente, como, por ejemplo, una bombilla de 1,5 V y 0,3 A, formando un circuito adecuado. Se determina la intensidad de la corriente devuelta. En el caso del acumulador descrito es igual a unos 0,5 A.
Si dejamos el sistema activo, observamos que la intensidad y, por tanto, la luz emitida por la bombilla tiende a disminuir rápidamente, obviamente en proporción al tiempo de carga.
Sobre la base de los resultados de la experiencia es fácil comprender por qué los acumuladores para vehículos tienen tensiones múltiples de la f.e.m. expresada por una sola célula, por ejemplo, 6 o 12 voltios: están constituidos, en efecto, por 3 o 6 células elementales conectadas en serie.
Disponiendo de al menos dos celdas electrolíticas educativas, es posible verificar lo anterior; además, es posible verificar que la conexión en paralelo de dos o más celdas elementales no conduce a un aumento de la tensión sino, más bien, a un aumento de la intensidad.
Al final del experimento se vacía la célula electrolítica, se lava con agua corriente y se deja secar al aire.
Para más información Operation of Lead Acid Batteries
Recomendaciones de seguridad
En todo momento se deben utilizar los elementos de seguridad básicos en el laboratorio de química (bata de laboratorio, guantes, gafas de seguridad y demás que sean exigidos por las normas internas, locales o nacionales. Los residuos generados por la práctica deben ser dispuestos de manera adecuada según las normas de laboratorio y las normas locales y nacionales respectivas.
Como citar este artículo:
APA: (2021-05-12). La batería de plomo-ácido. Recuperado de https://quimicafacil.net/manual-de-laboratorio/electroquimica/la-bateria-de-plomo-acido/
ACS: . La batería de plomo-ácido. https://quimicafacil.net/manual-de-laboratorio/electroquimica/la-bateria-de-plomo-acido/. Fecha de consulta 2026-02-13.
IEEE: , "La batería de plomo-ácido," https://quimicafacil.net/manual-de-laboratorio/electroquimica/la-bateria-de-plomo-acido/, fecha de consulta 2026-02-13.
Vancouver: . La batería de plomo-ácido. [Internet]. 2021-05-12 [citado 2026-02-13]. Disponible en: https://quimicafacil.net/manual-de-laboratorio/electroquimica/la-bateria-de-plomo-acido/.
MLA: . "La batería de plomo-ácido." https://quimicafacil.net/manual-de-laboratorio/electroquimica/la-bateria-de-plomo-acido/. 2021-05-12. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net