Tiempo de lectura estimado: 6 minutos
El electrodo de Castner fue uno de los primeros electrodos de grafito utilizados en la naciente industria de la electroquímica. El recubrimiento de grafito de estos electrodos le permitieron soportar las duras condiciones de procesos como el Castner–Kellner para la producción de sodio metálico.
La fuerza de la electricidad
El descubrimiento de Alessandro Volta de una fuente química de electricidad fue rápidamente seguido por la electrólisis del agua de William Nicholson. Ampliando la batería de Volta, Humphry Davy comenzó a electrolizar sales fundidas. Con electrodos de platino, Davy logró fundir varios metales alcalinos, dejando milagrosamente indemne su laboratorio en el Royal Institution de Londres. Durante las décadas siguientes, una «tierra» tras otra caía, produciendo metales brillantes. Eventualmente Henri Moissan incluso logró liberar el flúor de su sal.

Hoy en día, es difícil imaginar que el aluminio tenga un gran atractivo. Pero a mediados del siglo XIX, el aluminio era tan fantásticamente caro que Napoleón III de Francia usó una vajilla exquisitamente ligera para cimentar sus credenciales de «geek-chic». Con una enorme subvención del gobierno, el químico francés Henri Sainte-Claire Deville amplió el método de Friedrich Wöhler para obtener el metal del cloruro de aluminio con sodio. Pero sin una fuente barata de sodio, el precio se mantuvo alto.
La necesidad del sodio

Hamilton Castner, un estudiante impaciente de la Escuela de Minas de Columbia en Nueva York, EE.UU., estaba seguro de que había una mejor manera. Tomó los cursos que sentía que necesitaba y luego los dejó sin molestarse en completar su grado. Se estableció con su hermano como analista y consultor en el centro de Manhattan, y rápidamente construyó una reputación de minuciosidad y fiabilidad. Pero mientras el trabajo pagaba las facturas, él soñaba con sueños de aluminio. Después de meses de trabajo, Castner descubrió que el carburo de hierro podía reducir la sosa cáustica fundida a sodio elemental. De repente, la fundición de aluminio era una propuesta comercial.
Al no poder conseguir apoyos industriales en los EE.UU., se trasladó al Reino Unido en 1886, donde estableció la Compañía de Aluminio en Londres con el influyente químico Henry Roscoe. Pero justo cuando comenzó la producción, el desastre se produjo con la invención en los Estados Unidos y Francia del proceso electrolítico Hall-Héroult, en el que la criolita fundida -un buen disolvente para la alúmina- se redujo en los electrodos de carbono. En un ambiente fenomenalmente competitivo, Castner ideó métodos para convertir su abundante suministro de sodio en lejía de peróxido de sodio y cianuro de sodio para la industria minera del oro.
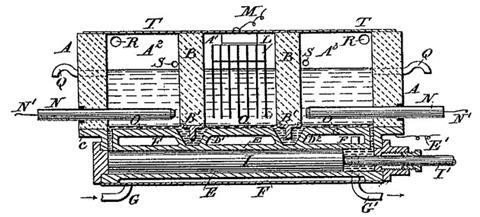
Con la esperanza de hacer el sodio aún más barato, comenzó a electrolizar la salmuera. Ya se había hecho antes, pero Castner usó una celda de tres compartimentos. La electrólisis generaba cloro en un ánodo de carbono, mientras que el sodio se disolvía en un cátodo de mercurio. Al balancear la celda, la amalgama de sodio y mercurio fluyó a otro compartimento, donde produjo soda cáustica e hidrógeno sin sal. Cuando Castner fue a la oficina de patentes, descubrió que una patente casi idéntica acababa de ser presentada por el químico austriaco Karl Kellner, cuyos derechos habían sido adquiridos por la empresa belga Solvay. Castner no sé rindió. Formó una empresa conjunta con Solvay, la Compañía Alcalina Castner-Kellner, y rápidamente se estableció una planta en Weston Point cerca de Runcorn, Reino Unido. Todavía está allí hoy en día.
El electrodo de Castner, pieza fundamental

Los electrodos eran un problema. Comprimir el hollín o el carbón en barras funcionaba, pero los ánodos se degradaban con rapidez, especialmente cuando eran sometidos a la acción de salmuera caliente, oxígeno o cloro. Castner decidió que las barras podían hacerse más robustas recubriéndolas con una capa impermeable de hollín y luego pasándoles con una corriente de 500A. «El calor generado es bastante inconmensurable», escribió en su patente, «y es tal que el carbono desprenderá el material más inflamable que contiene y el resto se convertirá en un carbono más fijo, de carácter grafitico». El resultado fueron varillas conductoras de una fuerza y durabilidad sin igual. Sin embargo, Castner tuvo poco tiempo para cosechar la recompensa de su ingenio. Menos de tres años después estaba muerto, víctima de la tuberculosis.
La Medalla de Oro Castner en Electroquímica Industrial es un premio bienal otorgado por el Grupo de Tecnología Electroquímica de la Sociedad de la Industria Química
Con su proceso electrolítico de cloroálcali, Castner y Kellner habían desatado un monstruo: las plantas de cloroálcali brotaron en todo el mundo, apuntalando la industria química, pero también convirtiéndose en una importante fuente global de mercurio en el medio ambiente. En 2013, un tratado mundial para reducir las emisiones de mercurio, largamente esperado, fue finalmente firmado por 140 países. Por todas sus virtudes, el proceso de cloroálcali pronto será historia.
Pero los maravillosos electrodos de carbono inertes – grafíticos, porosos, vidriosos – son omnipresentes. Se puede argumentar que el electrodo de Castner marca el momento en que el carbono comenzó a ser considerado como un material estructural. Hoy en día los aviones, los coches deportivos, los palos de golf y las horquillas de mi bicicleta están hechos de carbono pirolítico, más ligero y fuerte que el aluminio. Los monstruos a veces tienen forros negros.
Para más de información Castner’s electrode
Como citar este artículo:
APA: (2020-09-14). Electrodo de Castner. Recuperado de https://quimicafacil.net/infografias/material-de-laboratorio/electrodo-de-castner/
ACS: . Electrodo de Castner. https://quimicafacil.net/infografias/material-de-laboratorio/electrodo-de-castner/. Fecha de consulta 2026-03-08.
IEEE: , "Electrodo de Castner," https://quimicafacil.net/infografias/material-de-laboratorio/electrodo-de-castner/, fecha de consulta 2026-03-08.
Vancouver: . Electrodo de Castner. [Internet]. 2020-09-14 [citado 2026-03-08]. Disponible en: https://quimicafacil.net/infografias/material-de-laboratorio/electrodo-de-castner/.
MLA: . "Electrodo de Castner." https://quimicafacil.net/infografias/material-de-laboratorio/electrodo-de-castner/. 2020-09-14. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net