Tiempo de lectura estimado: 8 minutos
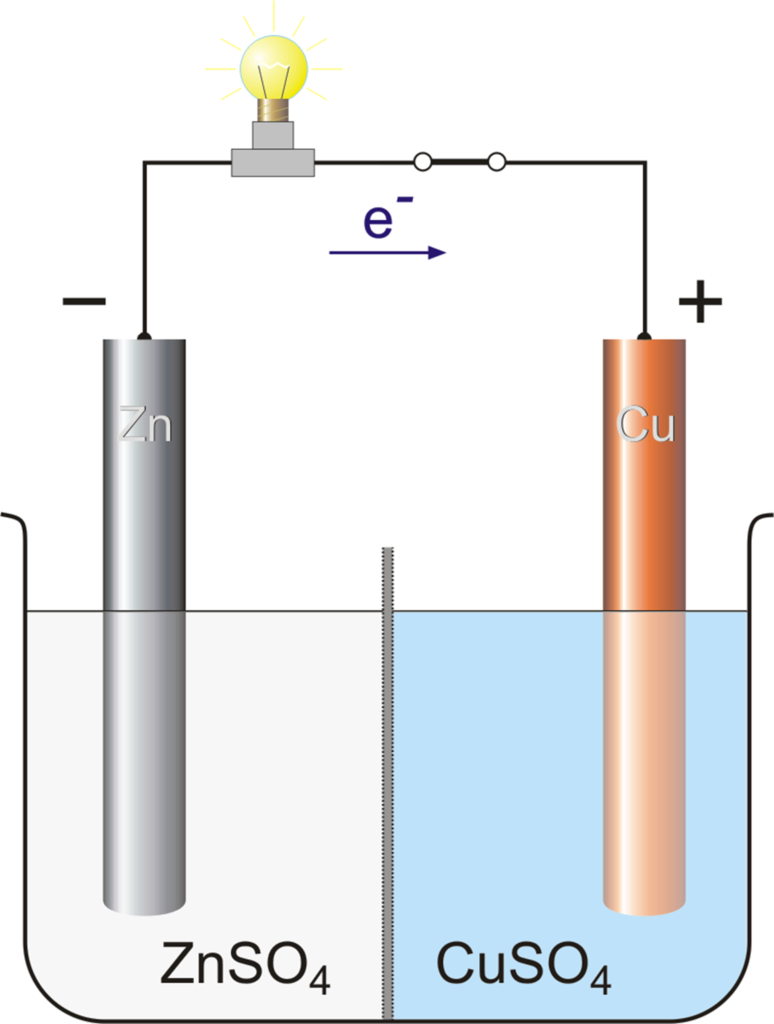
La celda de Daniell es un tipo de celda electroquímica inventada en 1836 por John Frederic Daniell, químico y meteorólogo británico, y consiste en una vasija de cobre llena de una solución de sulfato de cobre (II), en la que se sumerge un recipiente de barro sin esmaltar lleno de ácido sulfúrico y un electrodo de zinc.
Daniell buscaba una forma de eliminar el problema de las burbujas de hidrógeno que se encontraban en la pila voltaica, y su solución fue utilizar un segundo electrolito para consumir el hidrógeno producido por el primero. El ácido sulfúrico puede ser sustituido por sulfato de zinc.
La celda de Daniell supuso una gran mejora respecto a la tecnología existente en los primeros tiempos del desarrollo de las pilas. Una variante posterior de la celda Daniell, llamada celda de gravedad o de pata de gallo, fue inventada en la década de 1860 por un francés llamado Callaud y se convirtió en una opción popular para la telegrafía eléctrica.
La celda de Daniell es también la base histórica de la definición actual del voltio, que es la unidad de fuerza electromotriz en el Sistema Internacional de Unidades. Las definiciones de las unidades eléctricas que se propusieron en la Conferencia Internacional de Electricistas de 1881 se diseñaron para que la fuerza electromotriz de la celda Daniell fuera de aproximadamente 1,0 voltios. Con las definiciones actuales, el potencial estándar de la celda Daniell a 25 °C es en realidad de 1,10 V.
Historia de la celda de Daniell
Diseño original de Daniell
Daniell construyó su celda por primera vez en 1836. Su diseño original consistía en un cilindro de cobre de 3,5 pulgadas de diámetro. Un disco de cobre perforado con numerosos agujeros se colocó a lo largo del cilindro empotrado en la parte superior. Un tubo de garganta de buey colgaba de un gran agujero en el centro del disco de cobre perforado. Dentro de este tubo de buey colgaba una varilla de zinc de 0,5 pulgadas de diámetro suspendida de unos soportes de madera.
El recipiente de cobre se llenaba con una solución de ácido sulfúrico saturada de sulfato de cobre hasta por encima del nivel del disco perforado. El tubo de garganta de buey se llenaba con solución de ácido sulfúrico.
Los cristales de sulfato de cobre se apilaban en el disco perforado de cobre para mantener la solución saturada. El tubo de garganta de buey actuaba como una membrana porosa que permite el paso de los iones. Daniell afirmaba que se puede utilizar un tubo de barro poroso en lugar de la garganta de buey para facilitar la práctica, pero esta disposición producirá menos potencia.
Otra sugerencia de Daniell para mejorar la célula era sustituir el cobre por platino y el sulfato de cobre por el cloruro de platino, pero señala que «esta disposición sería perfecta, pero demasiado costosa para las aplicaciones ordinarias» Es la forma de vasija porosa de la celda la que llegó a ser ampliamente utilizada en telegrafía.
Celda de vasija porosa
La celda de vasija porosa consiste en un ánodo central de zinc sumergido en una vasija de barro porosa que contiene una solución de sulfato de zinc. La vasija porosa está, a su vez, sumergida en una solución de sulfato de cobre contenida en una lata de cobre, que actúa como cátodo de la celda.
El uso de una barrera porosa permite el paso de los iones, pero impide que las soluciones se mezclen. Sin esta barrera, cuando no hay corriente, los iones de cobre se desvían hacia el ánodo de zinc y se reducen sin producir corriente, lo que acorta la vida de la pila. La sustitución del ácido sulfúrico por el sulfato de zinc fue una innovación de J. F. Fuller en 1853, prolongando la vida de la celda.
Con el tiempo, la acumulación de cobre bloquea los poros de la barrera de barro y acorta la vida útil de la pila. No obstante, la celda Daniell proporciona una corriente más larga y fiable que la pila voltaica porque el electrolito deposita en el cátodo cobre, que es un conductor, en lugar de hidrógeno, que es un aislante. También es más segura y menos corrosiva. Con una tensión de funcionamiento de aproximadamente 1,1 voltios, se utilizó ampliamente en las redes telegráficas hasta que fue sustituida por la pila de Leclanché a finales de la década de 1860.
Celda de gravedad
En algún momento de la década de 1860, un francés llamado Callaud inventó una variante de la celda Daniell que prescindía de la barrera porosa. En su lugar, una capa de sulfato de zinc se asienta sobre una capa de sulfato de cobre, los dos líquidos se mantienen separados por sus diferentes densidades, a menudo con una capa de aceite añadida encima para evitar la evaporación. Esto reduce la resistencia interna del sistema y, por tanto, la batería produce una corriente más fuerte.
Esta variante, denominada pila de gravedad, consiste en un recipiente de cristal en el que un cátodo de cobre está sentado en el fondo y un ánodo de zinc está suspendido bajo el borde en la capa de sulfato de zinc. Alrededor del cátodo se esparcen cristales de sulfato de cobre y el frasco se llena de agua destilada.
A medida que se extrae la corriente, se forma una capa de solución de sulfato de zinc en la parte superior alrededor del ánodo. Esta capa superior se mantiene separada de la capa inferior de sulfato de cobre por su menor densidad y por la polaridad de la célula. Una de las desventajas de la célula de gravedad es que hay que aplicar continuamente una corriente para evitar que las dos soluciones se mezclen por difusión, por lo que no es adecuada para un uso intermitente. Además, es vulnerable a la pérdida de integridad si se extrae demasiada corriente eléctrica, lo que también hace que las capas se mezclen.
Llamada a veces celda de pata de gallo por la forma característica de los electrodos, esta disposición es menos costosa para las grandes baterías multicelulares y se convirtió rápidamente en la batería elegida para las redes telegráficas americanas y británicas. Incluso después de que la mayoría de las líneas telegráficas empezaran a ser alimentadas por motogeneradores, la pila de gravedad siguió utilizándose en las estaciones de vía para alimentar el circuito local al menos hasta los años 50 del siglo XX.
En la industria telegráfica, esta pila solía ser montada in situ por los propios trabajadores del telégrafo, y cuando se agotaba podía renovarse sustituyendo los componentes consumidos. La capa de sulfato de zinc es clara en contraste con la capa de sulfato de cobre, de color azul intenso, lo que permite a un técnico determinar la vida útil de la pila de un vistazo. Por otro lado, esta configuración significa que la pila sólo podría utilizarse en un aparato fijo, ya que de lo contrario las soluciones se mezclarían o se derramarían.
Otros impactos de la celda de Daniell
Una variante de la celda Daniell fue inventada en 1837 por el médico del hospital Guy, Golding Bird, que utilizó una barrera de yeso para mantener las soluciones separadas. Los experimentos de Bird con esta célula fueron de cierta importancia para la nueva disciplina de la electrometalurgia, pero el propio Bird no se dedicó a este campo; su interés era la electroterapia.
Un resultado sorprendente de los experimentos de Bird fue la deposición de cobre en el yeso poroso y en las venas que lo atravesaban sin ningún contacto con los electrodos metálicos. Tan sorprendente, de hecho, que al principio los investigadores electroquímicos, incluido Michael Faraday, no lo creyeron. El propio Bird tuvo que examinar cuidadosamente su aparato en busca de un contacto involuntario, quizás por el crecimiento de «bigotes» de cobre, antes de convencerse del resultado. La deposición de cobre, y de otros metales, ya se había observado anteriormente, pero siempre había sido metal sobre electrodo metálico.
John Dancer, un fabricante de instrumentos de Liverpool, fue el primero en aprovechar comercialmente las características únicas de la celda Daniell para el revestimiento de cobre. En un proceso que ahora se conoce como electrotipado, descubrió que podía fabricar objetos con cualquier forma deseada utilizando la barrera porosa como molde.
Sin embargo, muchos otros habían hecho el mismo descubrimiento y en una disputa por la patente con Thomas Spencer se señaló que Bird tenía la prioridad por el principio. El mérito de la invención de la electrotipia suele atribuirse al ruso Moritz von Jacobi.
Para más información Daniell Cell
Como citar este artículo:
APA: (2022-08-22). Celda de Daniell. Recuperado de https://quimicafacil.net/infografias/material-de-laboratorio/celda-de-daniell/
ACS: . Celda de Daniell. https://quimicafacil.net/infografias/material-de-laboratorio/celda-de-daniell/. Fecha de consulta 2026-03-07.
IEEE: , "Celda de Daniell," https://quimicafacil.net/infografias/material-de-laboratorio/celda-de-daniell/, fecha de consulta 2026-03-07.
Vancouver: . Celda de Daniell. [Internet]. 2022-08-22 [citado 2026-03-07]. Disponible en: https://quimicafacil.net/infografias/material-de-laboratorio/celda-de-daniell/.
MLA: . "Celda de Daniell." https://quimicafacil.net/infografias/material-de-laboratorio/celda-de-daniell/. 2022-08-22. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net