Estimated reading time: 4 minutos
Las PETasas son una clase de enzimas esterasas que catalizan la degradación (vía hidrólisis) del plástico de tereftalato de polietileno (PET) en monómeros de mono-2-hidroxietil tereftalato (MHET). La reacción química idealizada es:
donde \(n\) es el número de monómeros en la cadena polimérica, aunque una pequeña cantidad del PET se descompone en bis(2-hidroxietil) tereftalato (BHET). Las PETasas también pueden degradar plásticos de PEF (polietileno-2,5-furandicarboxilato), que es un reemplazo bioderivado del PET, en el análogo MHEF. Las PETasas no pueden catalizar la hidrólisis de poliésteres alifáticos como el succinato de polibutileno o el ácido poliláctico.
Mientras que la degradación del PET por medios naturales (no enzimáticos) toma cientos de años, las PETasas pueden degradarlo en cuestión de días.
Historia de la PETasa
La primera PETasa fue descubierta en 2016 en la cepa bacteriana **Ideonella sakaiensis** 201-F6, encontrada en muestras de lodo cerca de un sitio de reciclaje de botellas de PET en Japón.
Anteriormente se conocían otros tipos de hidrolasas capaces de degradar PET, como lipasas, esterasas y cutinasas. En comparación, se sabe que las enzimas que degradan poliésteres existen desde al menos 1975 (en el caso de la α-quimotripsina) y 1977 (lipasa).
El plástico PET comenzó a usarse de manera generalizada en la década de 1970, y se ha sugerido que las PETasas en bacterias evolucionaron recientemente. Es posible que la PETasa haya tenido una actividad enzimática pasada asociada con la degradación de una capa cerosa en plantas.
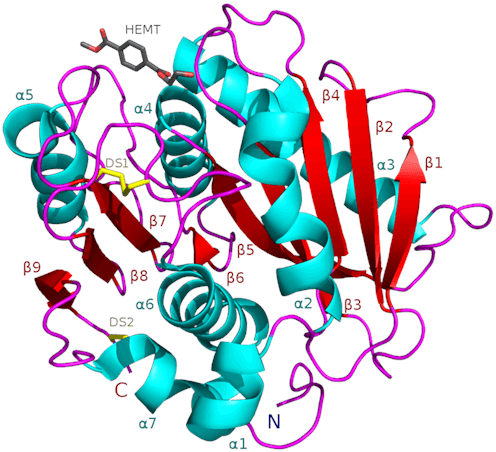
Estructura
Hasta abril de 2019, se conocían 17 estructuras cristalinas tridimensionales de PETasas: 6QGC, 6ILX, 6ILW, 5YFE, 6EQD, 6EQE, 6EQF, 6EQG, 6EQH, 6ANE, 5XJH, 5YNS, 5XFY, 5XFZ, 5XG0, 5XH2 y 5XH3.
La PETasa exhibe características compartidas con lipasas y cutinasas, ya que posee un pliegue α/β-hidrolasa. Sin embargo, la hendidura del sitio activo en la PETasa es más abierta que en las cutinasas. La PETasa de **I. sakaiensis** es similar a la dienelactona hidrolasa, según Pfam, y de acuerdo con ESTHER, pertenece a la familia de las poliesterasas-lipasas-cutinasas.
Existen aproximadamente 69 enzimas tipo PETasa, que comprenden una variedad de organismos diversos, y se clasifican en dos categorías: tipo I y tipo II. Se sugiere que 57 enzimas pertenecen a la categoría tipo I, mientras que el resto, incluida la PETasa encontrada en I. sakaiensis, pertenece al tipo II. Dentro de las 69 enzimas tipo PETasa, existen tres residuos conservados en el sitio activo, lo que sugiere que el mecanismo catalítico es el mismo en todas las formas de estas enzimas.
Mutaciones
El descubrimiento de la PETasa de I. sakaiensis ofrece una posible solución al problema global de la acumulación de plásticos; sin embargo, las enzimas que ocurren de forma natural tienen limitaciones en su capacidad de degradación debido a su inestabilidad, baja actividad y niveles de expresión, lo que impulsa la necesidad de mejoras para su uso a gran escala en aplicaciones industriales.
La mayoría de las estrategias implementan la mutagénesis dirigida para crear una versión mejorada, conocida como variante o mutante, de la enzima. Una variante aumentó la actividad de la PETasa en un 22.4% reemplazando la arginina por alanina en la cadena de aminoácidos en la posición 280.
De manera similar, se creó un doble mutante que constriñó el sitio activo y se volvió un 4.13% más activo que el tipo silvestre. Comparativamente, otros dos mutantes dobles crearon enlaces de hidrógeno adicionales que mejoraron la estabilidad de la PETasa. Otras estrategias exitosas para mejorar la estabilidad incluyen la adición de \(Ca^{2+}\) o \(Mg^{2+}\), la creación de enlaces disulfuro y puentes salinos, así como la glicosilación.
Para la estabilidad térmica, otro mutante doble mostró un aumento en comparación con el tipo silvestre. Además, el lazo conector β1-β2 de la enzima podría ser un futuro objetivo para mejorar la estabilidad térmica debido a su flexibilidad y distancia del sitio activo.
Ruta biológica
En I. sakaiensis, el MHET resultante es descompuesto aún más por la acción de la enzima MHETasa, que lo transforma en ácido tereftálico y etilenglicol. Los experimentos de laboratorio mostraron que las proteínas quiméricas, que unen artificialmente una MHETasa y una PETasa, superan a las mezclas similares de enzimas libres.
Para más información The world’s plastic pollution crisis, explained
Como citar este artículo:
APA: (2025-08-26). PETasa. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/petasa/
ACS: . PETasa. https://quimicafacil.net/compuesto-de-la-semana/petasa/. Fecha de consulta 2026-03-07.
IEEE: , "PETasa," https://quimicafacil.net/compuesto-de-la-semana/petasa/, fecha de consulta 2026-03-07.
Vancouver: . PETasa. [Internet]. 2025-08-26 [citado 2026-03-07]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/petasa/.
MLA: . "PETasa." https://quimicafacil.net/compuesto-de-la-semana/petasa/. 2025-08-26. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net