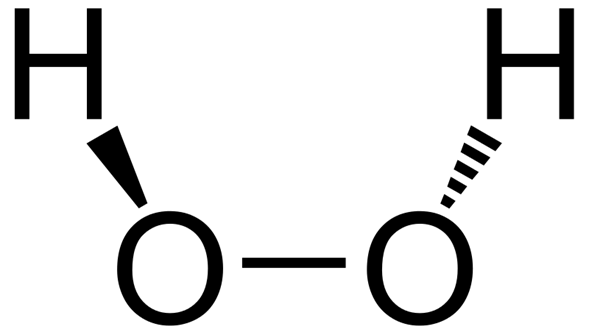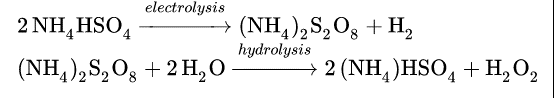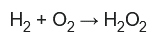Tiempo de lectura estimado: 12 minutos
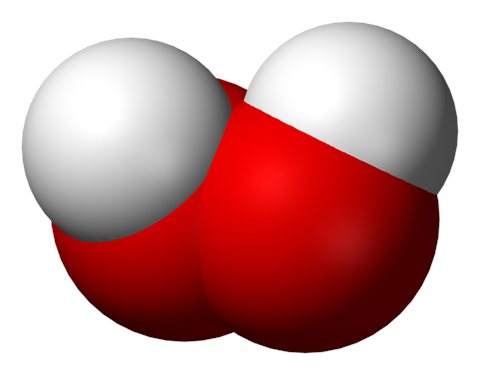
El peróxido de hidrógeno es un compuesto químico con la fórmula H2O2. En su forma pura, es un líquido azul muy pálido, ligeramente más viscoso que el agua. Se utiliza como oxidante, agente blanqueador y antiséptico, normalmente en forma de solución diluida (3-6% en peso) en agua para el consumo, y en concentraciones más altas para el uso industrial. El peróxido de hidrógeno concentrado, o «peróxido de alta resistencia», se descompone de forma explosiva cuando se calienta y se ha utilizado como propulsor en cohetería.
El peróxido de hidrógeno es una especie reactiva del oxígeno y el peróxido más simple, un compuesto que tiene un enlace simple oxígeno-oxígeno. Se descompone lentamente cuando se expone a la luz, y rápidamente en presencia de compuestos orgánicos o reactivos. Normalmente se almacena con un estabilizador en una solución débilmente ácida en una botella oscura para bloquear la luz. El peróxido de hidrógeno se encuentra en los sistemas biológicos, incluido el cuerpo humano. Las enzimas que utilizan o descomponen el peróxido de hidrógeno se clasifican como peroxidasas.
Historia
Alexander von Humboldt informó en 1799 de uno de los primeros peróxidos sintéticos, el peróxido de bario, como subproducto de sus intentos de descomponer el aire. Diecinueve años más tarde, Louis Jacques Thénard reconoció que este compuesto podía utilizarse para la preparación de un compuesto hasta entonces desconocido, que describió como eau oxygénée («agua oxigenada»), posteriormente conocido como peróxido de hidrógeno.
En la actualidad, el término «agua oxigenada» puede aparecer en los envases de los comercios para referirse a mezclas que contienen agua y peróxido de hidrógeno o agua y oxígeno disuelto. Esto podría causar daños personales si el usuario no entiende bien la diferencia.
Una versión mejorada del proceso de Thénard utilizaba ácido clorhídrico, seguido de la adición de ácido sulfúrico para precipitar el subproducto de sulfato de bario. Este proceso se utilizó desde finales del siglo XIX hasta mediados del siglo XX.
Thénard y Joseph Louis Gay-Lussac sintetizaron el peróxido de sodio en 1811. El efecto blanqueador de los peróxidos y sus sales sobre los tintes naturales se conoció en esa época, pero los primeros intentos de producción industrial de peróxidos fracasaron. La primera planta de producción de peróxido de hidrógeno se construyó en 1873 en Berlín. El descubrimiento de la síntesis de peróxido de hidrógeno por electrólisis con ácido sulfúrico introdujo el método electroquímico más eficaz.
Se comercializó por primera vez en 1908 en Weißenstein, Carintia, Austria. El proceso de la antraquinona, que todavía se utiliza, fue desarrollado durante la década de 1930 por el fabricante químico alemán IG Farben en Ludwigshafen. El aumento de la demanda y las mejoras en los métodos de síntesis hicieron que la producción anual de peróxido de hidrógeno pasara de 35.000 toneladas en 1950 a más de 100.000 toneladas en 1960 y a 300.000 toneladas en 1970; en 1998 alcanzó los 2,7 millones de toneladas.
Los primeros intentos de producir peróxido de hidrógeno puro fracasaron. El peróxido de hidrógeno anhidro se obtuvo por primera vez por destilación al vacío.
Estudiando su estructura
La determinación de la estructura molecular del peróxido de hidrógeno resultó muy difícil. En 1892, el físicoquímico italiano Giacomo Carrara (1864-1925) determinó su masa molecular por depresión del punto de congelación, lo que confirmó que su fórmula molecular es H2O2.
Al menos media docena de estructuras moleculares hipotéticas parecían ser consistentes con las pruebas disponibles. En 1934, el físico matemático inglés William Penney y el físico escocés Gordon Sutherland propusieron una estructura molecular para el peróxido de hidrógeno muy similar a la actualmente aceptada.
Anteriormente, el peróxido de hidrógeno se preparaba industrialmente por hidrólisis del persulfato de amonio, que a su vez se obtenía por electrólisis de una solución de bisulfato de amonio (NH4HSO4) en ácido sulfúrico:
Producción actual
En la actualidad, el peróxido de hidrógeno se fabrica casi exclusivamente mediante el proceso de antraquinona, desarrollado originalmente por BASF en 1939.
Comienza con la reducción de una antraquinona (como la 2-etilantraquinona o el derivado 2-amílico) a la antrahidroquinona correspondiente, normalmente por hidrogenación en un catalizador de paladio. En presencia de oxígeno, la antrahidroquinona sufre entonces una autoxidación: los átomos de hidrógeno lábiles de los grupos hidroxi se transfieren a la molécula de oxígeno, para dar peróxido de hidrógeno y regenerar la antraquinona.
La mayoría de los procesos comerciales logran la oxidación mediante el burbujeo de aire comprimido a través de una solución de antrahidroquinona, extrayendo luego el peróxido de hidrógeno de la solución y reciclando la antraquinona para ciclos sucesivos de hidrogenación y oxidación.
La reacción neta para el proceso catalizado por la antraquinona es:
La economía del proceso depende en gran medida del reciclaje efectivo de los disolventes de extracción, el catalizador de hidrogenación y la costosa quinona.
Usos
Blanqueo
Alrededor del 60% de la producción mundial de peróxido de hidrógeno se utiliza para el blanqueo de la pasta y el pape. La segunda aplicación industrial más importante es la fabricación de percarbonato de sodio y perborato de sodio, que se utilizan como blanqueadores suaves en los detergentes para la ropa. El percarbonato de sodio, que es un aducto de carbonato de sodio y peróxido de hidrógeno, es el ingrediente activo de productos para la ropa como OxiClean y el detergente Tide.
Cuando se disuelve en agua, libera peróxido de hidrógeno y carbonato de sodio, Por sí mismos, estos agentes blanqueadores sólo son eficaces a temperaturas de lavado de 60 °C (140 °F) o superiores, por lo que a menudo se utilizan junto con activadores de blanqueo, que facilitan la limpieza a temperaturas más bajas. También se ha utilizado como agente blanqueador de harina.
Producción de compuestos orgánicos
Se utiliza en la producción de varios peróxidos orgánicos, siendo el peróxido de dibenzoilo un ejemplo de gran volumen. Los peróxidos, como el ácido peracético y el ácido metacloroperoxibenzoico, también se producen con peróxido de hidrógeno. El peróxido de hidrógeno se ha utilizado para crear explosivos basados en peróxidos orgánicos, como el peróxido de acetona. Se utiliza como iniciador en las polimerizaciones.
Tratamiento de aguas residuales
El peróxido de hidrógeno se utiliza en ciertos procesos de tratamiento de aguas residuales para eliminar las impurezas orgánicas. En los procesos de oxidación avanzada, la reacción de Fenton da lugar al altamente reactivo radical hidroxilo (-OH). Esto degrada los compuestos orgánicos, incluidos los que normalmente son resistentes, como los compuestos aromáticos o halogenados. También puede oxidar los compuestos a base de azufre presentes en los residuos, lo que resulta beneficioso porque suele reducir su olor.
Desinfectante
El peróxido de hidrógeno puede utilizarse para la esterilización de diversas superficies, incluidas herramientas quirúrgicas, y puede emplearse como vapor (VHP) para la esterilización de habitaciones. El H2O demuestra una eficacia de amplio espectro contra virus, bacterias, levaduras y esporas bacterianas.
En general, se observa una mayor actividad contra las bacterias Gram-positivas que contra las Gram-negativas; sin embargo, la presencia de catalasa u otras peroxidasas en estos organismos puede aumentar la tolerancia en presencia de concentraciones más bajas. Los niveles más bajos de concentración (3%) funcionarán contra la mayoría de las esporas; las concentraciones más altas (7 a 30%) y los tiempos de contacto más largos mejorarán la actividad esporicida.
El peróxido de hidrógeno se considera una alternativa segura desde el punto de vista medioambiental a los blanqueadores a base de cloro, ya que se degrada para formar oxígeno y agua, y la Administración de Alimentos y Medicamentos de EE.UU. (FDA) lo reconoce generalmente como un agente antimicrobiano seguro.
Propelente
Alta concentración de H2O2 se denomina «peróxido de alta concentración» (HTP). Puede utilizarse como monopropelente (sin mezclar con el combustible) o como componente oxidante de un cohete bipropelente. El uso como monopropelente aprovecha la descomposición del peróxido de hidrógeno de concentración 70-98% en vapor y oxígeno. El propulsor se bombea a una cámara de reacción, donde un catalizador, normalmente una pantalla de plata o platino desencadena la descomposición, produciendo vapor a más de 600 °C (1.100 °F), que se expulsa a través de una boquilla, generando empuje.
El peróxido de hidrogeno produce un impulso específico máximo (Isp) de 161 s (1,6 kN-s/kg). El peróxido fue el primer monopropulsor importante adoptado para su uso en aplicaciones de cohetes. Con el tiempo, la hidracina sustituyó a las aplicaciones de propulsión con monopropelentes de peróxido de hidrógeno, principalmente debido a un aumento del 25% en el impulso específico en vacío.
La hidracina (tóxica) y el peróxido de hidrógeno (menos tóxico) son los únicos dos monopropelentes (aparte de los gases fríos) que han sido ampliamente adoptados y utilizados para aplicaciones de propulsión y potencia. [El cinturón de cohetes de Bell, los sistemas de control de la reacción para X-1, X-15, Centaur, Mercury, Little Joe, así como los generadores de gas de la turbo-bomba para X-1, X-15, Jupiter, Redstone y Viking utilizaron peróxido de hidrógeno como monopropelente.
Como bipropelente, el H2O2 se descompone para quemar un combustible como oxidante. Se pueden alcanzar impulsos específicos de hasta 350 s (3,5 kN-s/kg), dependiendo del combustible. El peróxido utilizado como oxidante da un Isp algo menor que el oxígeno líquido, pero es denso, almacenable, no criogénico y puede utilizarse más fácilmente para accionar turbinas de gas para dar altas presiones utilizando un ciclo cerrado eficiente. También puede utilizarse para la refrigeración regenerativa de los motores de cohetes.
El peróxido se utilizó con mucho éxito como oxidante en los motores de cohetes alemanes de la Segunda Guerra Mundial (por ejemplo, el T-Stoff, que contiene estabilizador de oxiquinolina, tanto para el sistema de propulsión monopropelente de vaina externa Walter HWK 109-500 Starthilfe RATO, como para la serie de motores de cohetes Walter HWK 109-509 utilizados para el Me 163B), utilizado con mayor frecuencia con el C-Stoff en una combinación hipergólica de autoencendido, y para los lanzadores británicos de bajo coste Black Knight y Black Arrow. Actualmente, la HTP se utiliza en los cohetes suborbitales ILR-33 AMBER y Nucleus.
Otros usos de peróxido de hidrogeno como combustible
En las décadas de 1940 y 1950, la turbina concebida por Hellmuth Walter KG utilizaba peróxido de hidrógeno para su uso en submarinos mientras estaban sumergidos; se descubrió que era demasiado ruidosa y requería demasiado mantenimiento en comparación con los sistemas de energía eléctrica diésel.
Algunos torpedos utilizaban peróxido de hidrógeno como oxidante o propulsor. Los errores de los operadores en el uso de los torpedos de peróxido de hidrógeno fueron señalados como posibles causas del hundimiento del HMS Sidon y del submarino ruso Kursk SAAB Underwater Systems fabrica el Torpedo 2000. Este torpedo, utilizado por la Armada sueca, está impulsado por un motor de pistón propulsado por HTP como oxidante y queroseno como combustible en un sistema bipropelente.
Uso doméstico
El peróxido de hidrógeno tiene varios usos domésticos, principalmente como agente de limpieza y desinfección.
El H2O2 diluido (entre el 1,9% y el 12%) mezclado con amoníaco acuoso se ha utilizado para decolorar el cabello humano. La propiedad blanqueadora del producto químico da nombre a la frase «rubio de peróxido». El peróxido de hidrógeno también se utiliza para blanquear los dientes. Puede encontrarse en la mayoría de los dentífricos blanqueadores.
El peróxido de hidrógeno ha mostrado resultados positivos en relación con los parámetros de luminosidad y cromatismo de los dientes. Funciona oxidando los pigmentos de color en el esmalte, con lo que el tono del diente puede volverse más claro. El peróxido de hidrógeno puede mezclarse con bicarbonato de sodio y sal para hacer una pasta de dientes casera.
El peróxido de hidrógeno reacciona con la sangre como agente blanqueador, por lo que, si una mancha de sangre es fresca, o no demasiado antigua, la aplicación de peróxido de hidrógeno, si es necesario en más de una aplicación, blanqueará la mancha completamente. Después de unos dos minutos de la aplicación, la sangre debe ser firmemente secada.
El peróxido de hidrógeno puede utilizarse para tratar el acné, aunque el peróxido de benzoilo es un tratamiento más común.
Barras luminosas
El peróxido de hidrógeno reacciona con ciertos diésteres, como el éster de oxalato de fenilo (cyalume), para producir quimioluminiscencia; esta aplicación se encuentra más comúnmente en forma de barritas luminosas.
Horticultura
Algunos horticultores y usuarios de hidroponía abogan por el uso de una solución débil de peróxido de hidrógeno en las soluciones de riego. Su descomposición espontánea libera oxígeno que mejora el desarrollo de las raíces de las plantas y ayuda a tratar la podredumbre de las raíces (muerte celular de las raíces por falta de oxígeno) y una variedad de otras plagas.
Para las concentraciones generales de riego se utiliza alrededor del 0,1%, que puede aumentarse hasta el uno por ciento para las acciones antifúngicas. Las pruebas demuestran que el follaje de las plantas puede tolerar con seguridad concentraciones de hasta el 3%.
Piscicultura
El peróxido de hidrógeno se utiliza en la acuicultura para controlar la mortalidad causada por diversos microbios. En 2019, la FDA estadounidense lo aprobó para el control de la saprolegniasis en todos los peces de aleta de agua fría y en todos los alevines y adultos de agua fría y templada, para el control de la enfermedad de la columnaris externa en los peces de aleta de agua templada y para el control de Gyrodactylus spp. en los salmónidos criados en agua dulce.
Las pruebas de laboratorio realizadas por los piscicultores han demostrado que el peróxido de hidrógeno doméstico común puede utilizarse de forma segura para proporcionar oxígeno a los peces pequeños. El peróxido de hidrógeno libera oxígeno por descomposición cuando se expone a catalizadores como el dióxido de manganeso.
Para más información Hydrogen Peroxide Solution
Como citar este artículo:
APA: (2022-05-31). Peróxido de hidrógeno. Recuperado de https://quimicafacil.net/compuesto-de-la-semana/peroxido-de-hidrogeno/
ACS: . Peróxido de hidrógeno. https://quimicafacil.net/compuesto-de-la-semana/peroxido-de-hidrogeno/. Fecha de consulta 2026-01-17.
IEEE: , "Peróxido de hidrógeno," https://quimicafacil.net/compuesto-de-la-semana/peroxido-de-hidrogeno/, fecha de consulta 2026-01-17.
Vancouver: . Peróxido de hidrógeno. [Internet]. 2022-05-31 [citado 2026-01-17]. Disponible en: https://quimicafacil.net/compuesto-de-la-semana/peroxido-de-hidrogeno/.
MLA: . "Peróxido de hidrógeno." https://quimicafacil.net/compuesto-de-la-semana/peroxido-de-hidrogeno/. 2022-05-31. Web.
Si tiene alguna pregunta o sugerencia, escribe a administracion@quimicafacil.net, o visita Como citar quimicafacil.net